Условно считают, что пептиды содержат до 100 аминокислотных остатков, а белки свыше 100. Пептидную или белковую молекулу формально можно представить как продукт поликонденсации аминокислот.
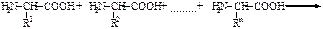
Пептидные и белковые цепи принято записывать с N-конца.По предложению К.У.Лидстрема-Ланга, различают четыре уровня организации белковых молекул - первичную, вторичную, третичную и четвертичную структуры.Основным методом определения аминокислотной последовательности белков или пептидов является метод Эдмана. Каждый цикл включает в основном две стадии: 1) образование фенилтиокарбомоилпептида; 2) отщепление N-концевого остатка аминокислоты в форме 3-фенил-2-тиогидантоина. Остальная часть пептидной цепи не разрушается, операции по отщеплению новой N-концевой аминокислоты можно повторить.
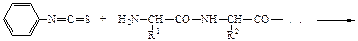 | |||
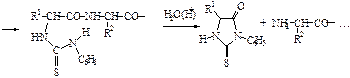 |
Необходимый этап для определения первичной структуры белка - расщепление белковой молекулы на пептидные фрагменты. Используют как ферментативные методы, так и химические. Метод автоматизирован, с помощью секвенаторов можно автоматически осуществлять 40-50 стадий отщепления. Фенилтиогидантоиновые производные идентифицируются методами тонкослойной или газожидкостной хроматографии.
6.Пептиды и белки. Строение и синтез. Названия пептидов строятся путем последовательного перечисления аминокислотных остатков, начиная с N-конца, с добавлением суффикса "ил", для последней С-концевой кислоты сохраняется ее полное название (например, глицилаланилсерин). Пептиды и белки имеют строгую последовательность. Из-за бифункциональности аминокислот даже из 2 аминокислот, например, глицина и аланина можно получить 4 дипептида: глицилглицин, аланилаланин, аланилглицин и глицилаланин. Для синтеза пептидов из сотен остатков разработана методика защиты одних и активации других функциональных групп.
Схема синтеза глицилаланина.
1 стадия - подготовка компонентов.
в глицине - будущем N-конце
а) защищают аминогруппу
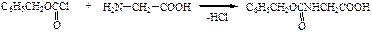
б) активируют карбоксильную группу
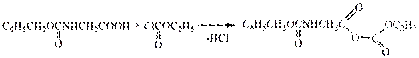
в аланине - будущем С-конце:
а) защищают карбоксильную группу
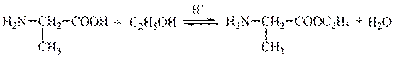
II стадия - образование амидной связи
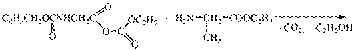
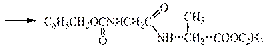
III стадия - удаление защиты
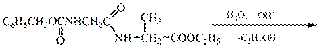
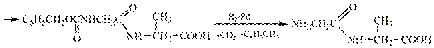
При таком способе необходимы выделение и очистка продукта на каждой стадии, что ведет к потерям.
В настоящее время используют твердофазный метод синтеза пептидов (Меррифилд, 1962 г.). В этом методе применяют твердый носитель (твердую фазу) в виде зерен полимерной смолы, содержащей хлорметильные «якорные» группы. Первая аминокислота - будущий С-конец - с защищенной аминогруппой прикрепляется к поверхности твердой фазы за счет карбоксильной группы. После удаления защиты присоединяют вторую аминокислоту с защищенной аминогруппой, защиту снова удаляют, отмывают примеси - и полимер готов для следующей стадии. После окончания синтеза полипептид снимают с твердой фазы действием НBr.
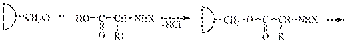
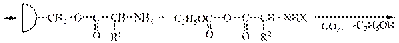
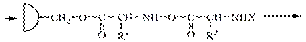
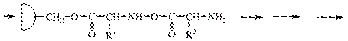

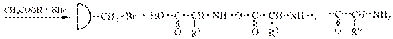
В пептидной (амидной) группе за счет p,p-сопряжения увеличивается энергетический барьер вращения вокруг связи C-N

Наиболее выгодным является транс-расположение заместителей, в этом случае заместители R наиболее удалены друг от друга в пространстве
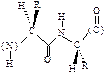
 2015-09-06
2015-09-06 1583
1583