Закон сохранения момента импульса накладывает ограничения на возможные переходы электрона в атоме водорода с одного уровня на другой (правила отбора). В энергетическом спектре атома водорода (рисунок) запрещённым переходом является …
ВАРИАНТЫ ОТВЕТОВ:
 1) 3s – 2p
1) 3s – 2p
2) 4s – 3p
3) 4s – 3d
4) 2p – 1s
---------------------------
Указание к заданиям № 34 - 45
ПОСТУЛАТЫ БОРА
Первый постулат. В атоме существуют стационарные (не изменяющиеся со временем) состояния, характеризующиеся определенными дискретными значениями энергии. Стационарным состояниям атома соответствуют стационарные op6иты, на которых находятся электроны. В соответствии с первым постулатом Бора электрон, двигаясь по круговой стационарной орбите обладает определенным значением момента импульса, удовлетворяющем условию:
 ,
,
где me –масса электрона,
υn – скорость электрона на n -й орбите радиуса rn,
ħ=h/2π (h – постоянная Планка).
Радиус n -ой орбиты для атома водорода:
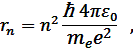
где e – заряд электрона, ε о – электрическая постоянная.
По теории Бора полная энергия электрона в атоме водорода может принимать дискретный ряд значений:
|
|
|
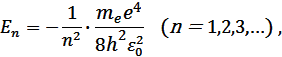
где n – номер орбиты электрона (номер стационарного состояния атома).
Второй постулат. При переходе электрона с одной орбиты на другую излучается фотон с энергией hν, равной разности энергий соответствующих стационарных состояний En и Еm:
hν= En– Em.
Наборвозможных дискретных частот ν переходов атома между стационарными состояниями атома определяет линейчатый спектр атома.
В спектре атома водорода частота квантового перехода:
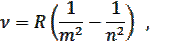
где R – постоянная Ридберга, m = 1, 2, 3, …; n = m +1, m +2, m +3, …
Эта обобщенная формула Бальмера описывает серии линий в спектре атома водорода, где m определяет серию (m = 1, 2, 3…), а n определяет отдельные линии соответствующей серии (n = m +1, m +2, …).
В ультрафиолетовой области спектра атома водорода наблюдается
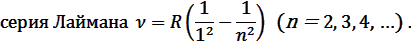
В видимой области спектра атома водорода наблюдается
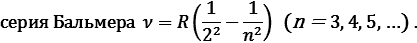
В инфракрасной области спектра атома водорода наблюдаются
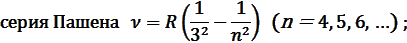
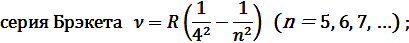
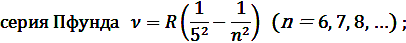
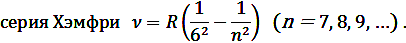
В квантовой механике считается, что электрон при своем движении как бы «размазан» по всему объему, образуя электронное облако, плотность (густота) которого характеризует вероятность нахождения электрона в различных точках объема. Размер, форму и ориентацию электронного облака в пространстве характеризуют, соответственно, квантовые числа n, l и ml.
n (главное квантовое число) определяет энергетические уровни электрона в атоме, принимая следующие значения: п = 1,2,3,...;
l (орбитальное квантовое число) определяет форму электронного облака, принимая следующие значения: l = 0, 1, 2,... n –1;
ml (магнитное квантовое число определяет ориентацию электронного облака в пространстве, принимая следующие значения: ml =0, ±1, ±2, …± l.
|
|
|
Состояние электрона в атоме водорода определяется набором квантовых чисел.
При l = 0 состояние электрона называется s -состоянием, при l= 1состояние электрона соответствует р -состоянию, при l = 2 – d -состоянию и т. д.
При записи состояния электрона значение n указывается перед условным обозначением орбитального квантового числа, например, 2s (n = 2, l = 0).
Правила, ограничивающие число возможных переходов электронов при испусканием или при поглощением света, называются правилами отбора.
Правила отбора для орбитального и магнитного квантовых чисел:
∆ l = ±1; ∆ ml = 0, ±1.
С учетом этих правил отбора спектральной серии Лаймана соответствуют переходы: np → 1 s (n = 2, 3, 4,...), а для серии Бальмера соответствуют переходы np → 2 s, ns → 2 p, nd → 2 p (n = 3, 4,...) и т. д.
 2015-10-16
2015-10-16 1182
1182








