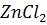 →
→ 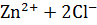 (2)
(2)
v = 2+1 = 3 d = 1 i = 3
Моляльность раствора
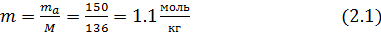

Криоскопическая константа для воды равна К = 1.86
Понижения температуры замерзания растворителя

Δ 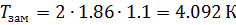
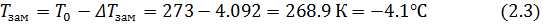

При дальнейшем охлаждении раствора до заданной температуры ta=-40 из него будут выделяться кристаллы воды (лед), а концентрация раствора будет увеличиваться по линии ликвидуса bdE и в точке d достигнет md = 850/136=
=6.25 моль/кг
Пусть на концентрирование поступает Ga=300 кг раствора 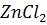 переводим рабочие концентрации в массовые доли г/кг раствора:
переводим рабочие концентрации в массовые доли г/кг раствора:
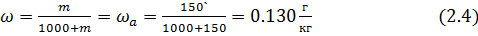

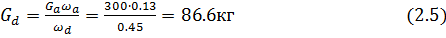
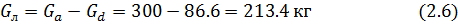
Вывод: Таким образом, методом вымораживания растворителя масса сточных вод снизилась с 300 кг до 213 кг, а концентрация их повысилась 0.45/0.13= 3.4 раза.
Концентрирование раствора  методом испарения растворителя
методом испарения растворителя
Дальнейшее увеличение концентрации раствора может быть достигнуто выпариванием растворителя.
Повышение температуры кипения

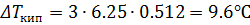
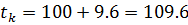
Моляльность раствора
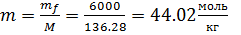 (3.1)
(3.1)

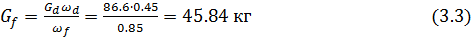
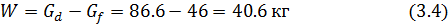
Вывод: В результате выпаривания получаем 63 кг раствора и 107.8 кг пара.
Кристаллизация ZnC  из концентрированного раствора
из концентрированного раствора
Вычислим количества выделенных кристаллов ZnC 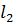 и маточного раствора
и маточного раствора 
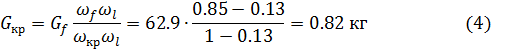
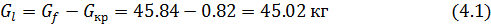
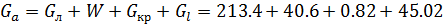 =299.84 кг
=299.84 кг
Вывод:В результате кристаллизации вещества получаем соли 0.82кг и 45.02 кг маточного раствора. При проверке убедились что расчёт верный.
 2015-10-16
2015-10-16 563
563







