В отношении набора всех витаминов уникальна печень. Дрожжи богаты витаминами группы В, рыбий жир – витамином Д. Витамин А содержится в коровьем масле с высоким содержанием молочного жира; витамины Е и F- в растительных маслах (однако последние должны быть абсолютно свежими). Овощи и фрукты богаты, главным образом, витамином С, каротином (особенно много β-каротинов содержится в моркови), фолиевой кислотой и биофлавоноидами. Всех других витаминов в овощах и фруктах мало. Источником витаминов В1, В6, РР является чёрный хлеб, нежирное мясо, бобовые, орехи; витамина В2 – молоко и молочные продукты. Ценным витаминоносителем (фолата, витамина РР и др.) является куриное яйцо.
Сохранность витаминов. Аскорбиновая кислота – самая нестойкая из витаминов, она легко разрушается на свету и при нагревании. Витамины А, Е, К и провитамин каротин достаточно устойчивы к действию высокой температуры при варке пищи, но очень чувствительны к свету и кислороду воздуха. Тиамин чувствителен к нагреванию.
Таким образом, только разнообразная, полноценная по всем компонентам пищи и достаточная по энергетической ценности диета может гарантировать профилактику гиповитаминозов.
Каждый человек должен получать витамины ежедневно, в полном наборе и количествах, обеспечивающих физиологическую потребность организма.
Витамин В1 (Tиамин. Антиневритный витамин)
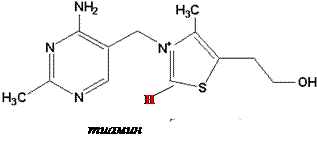 Химическое строение и свойства. Витамин В1 был первым витамином, выделенным в кристаллическом виде К. Функом в 1912 г. Позже был осуществлён его химический синтез. Своё название – тиамин – этот витамин получил из-за наличия в составе его молекулы атома серы и амино-группы.
Химическое строение и свойства. Витамин В1 был первым витамином, выделенным в кристаллическом виде К. Функом в 1912 г. Позже был осуществлён его химический синтез. Своё название – тиамин – этот витамин получил из-за наличия в составе его молекулы атома серы и амино-группы.
Тиамин состоит из 2-х гетероциклических колец – аминопиримидинового и тиазолового. Последнее содержит каталитически активную функциональную группу – карб-анион (относительно кислый углерод между серой и азотом).
Тиамин хорошо сохраняется в кислой среде и выдерживает нагревание до высокой температуры. В щелочной среде, например при выпечке теста с добавлением соды или карбоната аммония, он быстро разрушается.
Метаболизм. В желудочно-кишечном тракте различные формы витамина гидролизуются с образованием свободного тиамина. Большая часть тиамина всасывается в тонком кишечнике с помощью специфического механизма активного транспорта, остальное его количество расщепляется тиаминазой кишечных бактерий. С током крови всосавшийся тиамин попадает вначале в печень, где фосфорилируется тиаминпирофосфокиназой, а затем переносится в другие органы и ткани.
ТПФ-киназа
 АТФ + тиамин тиаминпирофосфат + АМФ
АТФ + тиамин тиаминпирофосфат + АМФ
Существует мнение, что основной транспортной формой тиамина является ТМФ.
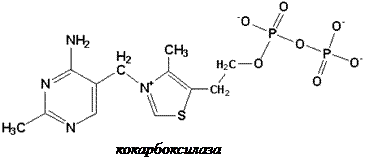 Витамин В1 присутствует в различных органах и тканях как в форме свободного тиамина, так и его фосфорных эфиров: тиаминмонофосфата (ТМФ), тиаминдифосфата (ТДФ, синонимы: тиаминпирофосфат, ТПФ, кокарбоксилаз а) и тиаминтрифосфата (ТТФ).
Витамин В1 присутствует в различных органах и тканях как в форме свободного тиамина, так и его фосфорных эфиров: тиаминмонофосфата (ТМФ), тиаминдифосфата (ТДФ, синонимы: тиаминпирофосфат, ТПФ, кокарбоксилаз а) и тиаминтрифосфата (ТТФ).
ТТФ – синтезируется в митохондриях с помощью фермента ТПФ-АТФ-фосфотрансферазы:
трансфереза
 ТПФ + АТФ ТДФ + АМФ
ТПФ + АТФ ТДФ + АМФ
Основной коферментной формой (60-80% от общего внутриклеточного содержания) является ТПФ.
ТТФ играет важную роль в метаболизме нервной ткани. При нарушении его образования развивается некротизирующая энцефалопатия.
После распада коферментов свободный тиамин выделяется с мочой и определяется в виде тиохрома.
Биохимические функции. Витамин В1 в форме ТПФ является составной частью ферментов, катализирующих реакции прямого и окислительного декарбоксилирования кетокислот.
Участие ТПФ в реакциях декарбоксилирования кетокислот объясняется необходимостью усиления отрицательного заряда углеродного атома карбонила кетокислоты в переходном, нестабильном, состоянии:
О


 ║
║
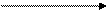 - О – С – C = O CO2 + -C = O
- О – С – C = O CO2 + -C = O
│ │
R R
Кетокислота переходное состояние
Переходное состояние стабилизируется ТПФ путём делокализации отрицательного заряда карб-аниона тиазолового кольца, играющего роль своеобразного электронного стока. Вследствие такого протонирования образуется активный ацетальдегид (гидроксиэтил-ТПФ).
Аминокислотные остатки белков обладают слабой способностью осуществлять то, что с лёгкостью делает ТПФ, поэтому апобелки нуждаются в коферменте. ТПФ жестко связан с апоферментом мультиферментных комплексов дегидрогеназ α-оксикетокислот (см. ниже).
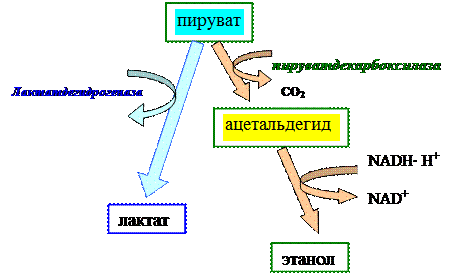 1. Участие ТПФ в реакции прямого декарбоксилирования пировиноградной кислоты (ПВК). При декарбоксилировании ПВК с помощью пируватдекарбоксилазы образуется ацетальдегид, который под воздействием алкогольдегидрогеназы превращается в этанол.ТПФ является незаменимым кофактором пируватдекарбоксилазы. Этим ферментом богаты дрожжи.
1. Участие ТПФ в реакции прямого декарбоксилирования пировиноградной кислоты (ПВК). При декарбоксилировании ПВК с помощью пируватдекарбоксилазы образуется ацетальдегид, который под воздействием алкогольдегидрогеназы превращается в этанол.ТПФ является незаменимым кофактором пируватдекарбоксилазы. Этим ферментом богаты дрожжи.
2. Участие ТПФ в реакциях окислительного декарбоксилирования. Окислительное декарбоксилирование ПВК катализирует пируватдегидрогеназа. В состав пируватдегидрогеназного комплекса входит несколько структурно связанных ферментных белков и коферментов (см.гл.) ТПФ катализирует начальную реакцию декарбоксилирования ПВК. Эта реакция идентична катализируемой пируватдекарбоксилазой. Однако в отличие от последней, пируватдегидрогеназа не превращает промежуточный продукт гидроксиэтил-ТПФ в ацетальдегид. Вместо этого гидроксиэтильная группа переносится к следующему ферменту в мультиферментной структуре пируватдегидрогеназного комплекса.
Окислительное декарбоксилирование ПВК является одной из ключевых реакций в обмене углеводов. В результате этой реакции ПВК, образовавшаяся при окислении глюкозы, включается в главный метаболический путь клетки – цикл Кребса, где окисляется до углекислоты и воды с выделением энергии. Таким образом, благодаря реакции окислительного декарбоксилирования ПВК создаются условия для полного окисления углеводов и утилизации всей заключенной в них энергии. Кроме того, образующаяся при действии ПДГ-комплекса активная форма уксусной кислоты служит источником для синтеза многих биологических продуктов: жирных кислот, холестерина, стероидных гормонов, ацетоновых тел и других.
Окислительное декарбоксилирование α-кетоглутатарата катализирует α–кетоглута-ратдегидрогеназа. Этот фермент является составной частью цикла Кребса. Строение и механизм действия α-кетоглутаратдегидрогеназного комплекса схожи с пируватдегидрогеназой, т.е. ТПФ также катализирует начальный этап превращения кетокислоты. Таким образом, от степени обеспеченности клетки ТПФ зависит бесперебойная работа этого цикла.
Помимо окислительных превращений ПВК и α-кетоглутарата, ТПФ принимает участие в окислительном декарбоксилировании кетокислот с разветвлённым углеродным скелетом (продукты дезаминирования валина, изолейцина и лейцина). Эти реакции играют важную роль в процессе утилизации аминокислот и, следовательно, белков клеткой.
3. ТПФ – кофермент транскетолазы. Транскетолаза – фермент пентозофосфатного пути окисления углеводов. Физиологическая роль этого пути заключается в том, что он является основным поставщиком НАДФH. H+ и рибозо-5-фосфата. Транскетолаза переносит двууглеродные фрагменты от ксилулозо-5-фосфата к рибозо-5-фосфату, что приводит к образованию триозофосфата (3-фосфоглицеринового альдегида) и 7 С сахара (седогептулозо-7-фосфата). ТПФ необходим для стабилизации карб-аниона, образующегося при расщеплении связи С2 - С3 ксилулозо-5-фосфата.
4. Витамин В1 принимает участие в синтезе ацетилхолина, катализируя в пируватдегидрогеназной реакции образование ацетил-КоА – субстрата ацетилирования холина.
5. Помимо участия в ферментативных реакциях, тиамин может выполнять и некоферментные функции, конкретный механизм которых ещё нуждается в уточнении. Полагают, что тиамин участвует в кроветворении, на что указывает наличие врождённых тиаминзависимых анемий, поддающихся лечению высокими дозами этого витамина, а также в стероидогенезе. Последнее обстоятельство позволяет объяснить некоторые эффекты препаратов витамина В1 как опосредованных стресс-реакцией.
Гиповитаминоз. Уже ранние проявления гиповитаминоза сопровождаются снижением аппетита и тошнотой. Отмечаются неврологические расстройства, к которым относятся нарушение периферической чувствительности, ощущение ползания «мурашек», невралгии. Характерна забывчивость, особенно на недавние события. Слабость сердечной мышцы проявляется тахикардией даже при незначительных нагрузках.
Недостаток в пище тиамина приводит к значительному накоплению пировиноградной и α-кетоглутаровой кислот, снижению активности тиаминзависимых ферментов в крови и тканях организма.
В эксперименте показано, что тиаминовая недостаточность сопровождается нарушением структуры и функции митохондрий. Добавление к последним ТПФ нормализует тканевое дыхание. У белых крыс, лишенных таимина, развивалась анорексия, уменьшалась масса тела. Шерсть теряла свой блеск, становилась взъерошенной. Животные мало двигались и обычно лежали, свернувшись в углу клетки. Анорексия является результатом резкого угнетения секреции желудочного сока и ослаблением его переваривающей способности.
Алиментарная недостаточность тиамина у человека приводит к патологическим изменениям в нервной, сердечно-сосудистой и пищеварительной системах, сопровождаясь общим истощением организма.
Болезнь «бери-бери» возникает при значительном дефиците тиамина и характеризуется крайне тяжёлым течением. В прошлом веке в странах Востока унесла миллионы жизней. «Бери-бери» в переводе с индийского означает «овца». Походка больного, действительно, похожа на поступь овцы (симптом симметричного опускания стоп). Поскольку у заболевших отмечалась тяжесть в ногах и скованность походки, «бери-бери» называлась также «кандальной болезнью». Этим заболеванием часто страдали заключённые, рацион питания которых состоял в основном из очищенного риса. Проявление недостаточности тиамина можно наблюдать до сих пор у бедных лиц в тех странах, где основу питания населения составляет полированный рис – в шлифованном зерне, в отличие от неочищенного, нет этого витамина. Последняя эпидемия «бери-бери» была на Филиппинах в 1953 г (погибло 100 000 человек).
Болезнь имеет 2 формы: сухую (нервно-паралитическую) и отёчную (сердечную). Причем в обоих случаях поражаются и сердечно-сосудистая и нервная системы, но в разной степени. В настоящее время классической «бери-бери», по-видимому, уже нет, однако явления умеренного гиповитаминоза отмечаются часто. К основным симптомам недостаточности тиамина относятся: физическая слабость, снижение аппетита (витамин В1 необходим для стимуляции желудочной секреции), стойкие запоры; расстройство функции нервной системы (онемение пальцев, чувство «ползания мурашек», утрата периферических рефлексов, боль по ходу нервов); нарушения психической деятельности (раздражительность, забывчивость, страх, иногда галлюцинации, снижение интеллекта). Позже развивается глубокое поражение нервной системы, характеризующееся потерей чувствительности конечностей, развитием параличей, атрофией мышц в результате нарушения их иннервации. При отёчной форме, наряду с явлениями полиневрита, отмечаются тахикардия и одышка даже при незначительных нагрузках. Из-за слабости сердечной мышцы развиваются отёки. Особенно часто проявления тиаминовой недостаточности наблюдаются у хронических алкоголиков вследствие их склонности больше пить, чем есть. Синдром Вернике, развивающийся у этих лиц, характеризуется нарушением координации движений, зрительной функции, спутанностью сознания.
Особая чувствительность нервной ткани к недостатку тиамина объясняется тем, что коферментная форма этого витамина абсолютно необходима нервным клеткам для усвоения глюкозы, которая является для них почти единственным источником энергии (большинство других клеток организма может использовать иные энергетические вещества, например жирные кислоты). Кстати, питание преимущественно углеводной пищей (белый хлеб, сладости) приводит к повышенной потребности в тиамине и, следовательно, развитию вторичной тиаминовой недостаточности.
Врождённые нарушения обмена тиамина.
Синдром Wernicke-Кorsakoff. В основе этого синдрома, сопровождающегося потерей памяти и частичным параличом, лежит изменение свойств фермента транскетолазы, у которой уменьшается сродство к ТПФ. Гены других ТПФ-зависимых ферментов не затрагиваются. Заболевание проявляется, если уровень потребляемого ТПФ снижается ниже значений, необходимых для насыщения транскетолазы. Синдром часто встречается у хронических алкоголиков при недостаточном потреблении ими витаминов.
Перемежающаяся атаксия. Заболевание обусловлено врождённым дефектом пируватдегидрогеназы.
Тиаминзависимая форма болезни «моча с запахом кленового сиропа». При этой патологии отмечается дефект окислительного декарбоксилирования разветвлённых кетокислот. В крови и моче резко увеличивается содержание разветвлённых кетокислот (отсюда – специфический запах мочи) и их субстратов – аминокислот валина, изолейцина и лейцина. Клиническая симптоматика схожа с терминальной стадией В1-недостаточности.
Подострая некротизирующая энцефалопатия. При этом заболевании нарушается образование ТТФ в мозге. Энцефалопатия проявляется в потере аппетита, рвоте, затруднении сосания. Младенцы теряют способность держать головку, у них отмечаются многочисленные неврологические расстройства. Болезнь заканчивается без лечения летально в течение первых лет жизни.
Тиаминзависимая мегалобластическая анемия. Механизм участия тиамина в кроветворении до конца не выяснен.
Гипервитаминоз не описан. Избыток принятого витамина быстро выводится с мочой, но у некоторых лиц имеется повышенная чувствительность к парэнтеральному введению препаратов тиамина.
Оценка обеспеченности организма тиамином. С этой целью обычно определяют содержание витамина и/или его коферментов в эритроцитах крови. Поскольку при недостатке витамина В1 нарушается окислительное декарбоксилирование кетокислот, увеличение содержания в крови и моче пировиноградной и α-кетоглутаровой кислот будет свидетельствовать о недостатке тиамина в организме. Однако следует иметь в виду, что накопление пирувата отмечается не только при гиповитаминозе В1, но и при гипоксии и других патологических состояниях.
Наилучшим способом судить о степени обеспеченности организма витамином В1 является определение активности тиаминзависимых ферментов. Однако активность пируват- и α–кетоглутаратдегидогеназ снижается только при глубоком гиповитаминозе, поскольку их апофермент прочно связывает ТПФ. Транскетолаза связывает ТПФ слабее и активность её в эритроцитах начинает снижаться уже на ранних стадиях гиповитаминоза В1. Если к образцу крови добавить ТПФ, то величина возрастания активности транскетолазы (так называемый ТПФ-эффект) позволит судить о степени недостаточности тиамина.
Суточная потребность. Пищевые источники.
Довольно много витамина В1 содержится в пшеничном хлебе из муки грубого помола, в оболочке семян хлебных злаков, в сое, фасоли, горохе. Много его в дрожжах. Меньше – в картофеле, моркови, капусте. Из продуктов животного происхождения наиболее богаты тиамином печень, нежирная свинина, почки, мозг, яичный желток. В настоящее время дефицит витамина В1 становится одной из проблем питания, так как из-за высокого потребления сахара и кондитерских изделий, а также белого хлеба и шлифованного риса существенно увеличивается расход этого витамина в организме. Использовать дрожжи в качестве источника витамина не рекомендуется из-за высокого содержания в них пуринов, что может приводить к возникновению обменного артрита (подагры).
Суточная потребность в тиамине – 1,1-1,5 мг.
Витамин В2 (Рибофлавин).
Химическое строение и свойства. Витамин В2 отличается от других витаминов жёлтым цветом (flavus – жёлтый). Однако, в отличие от окисленной, жёлтой, восстановленная форма витамина бесцветна.
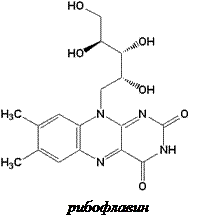 Рибофлавин впервые был выделен из кисломолочной сыворотки. Синтезирован Р. Куном в 1935 г. Молекула рибофлавина состоит из гетероциклического изоаллоксазинового ядра, к которому присоединён в 9 положении спирт рибитол (производное D-рибозы). Термином «флавины» обозначаются многие производные изоаллоксазина, обладающие В2 -витаминной активностью.
Рибофлавин впервые был выделен из кисломолочной сыворотки. Синтезирован Р. Куном в 1935 г. Молекула рибофлавина состоит из гетероциклического изоаллоксазинового ядра, к которому присоединён в 9 положении спирт рибитол (производное D-рибозы). Термином «флавины» обозначаются многие производные изоаллоксазина, обладающие В2 -витаминной активностью.
Биосинтез флавинов осуществляется растительными и многими бактериальными клетками, а также плесневыми грибками и дрожжами. Благодаря микробному биосинтезу рибофлавина в желудочно-кишечном тракте жвачные животные не нуждаются в этом витамине. У других животных и человека синтезирующихся в кишечнике флавинов недостаточно для предупреждения гиповитаминоза.
Витамин В2 хорошо растворим в воде, устойчив в кислой среде, но легко разрушается в нейтральной и щелочной, а также под действием видимого и УФ-облучения.
Метаболизм. В пище витамин В2 находится преимущественно в составе своих коферментных форм, связанных с белками, – флавопротеинов. Под влиянием пищеварительных ферментов витамин высвобождается и всасывается путём простой диффузии в тонком кишечнике. В энтероцитах рибофлавин фосфорилируется до ФМН (флавин-мононуклеотида) и ФАД (флавин-аденин-динуклеотида). Реакции протекают следующим образом:
1. 5`-ОН-группа боковой цепи рибитола фосфорилируется флавокиназой c образованием FMN.
 АТФ флавокиназа AДФ
АТФ флавокиназа AДФ
Рибофлавин рибофлавин-5-фосфат (FMN)
1. FMN с помощью фосфатных связей соединяется с аденозин-монофосфатом при участии фермента пирофосфорилазы.
ATФ ФФн
 пирофосфорилаза
пирофосфорилаза
ФМН ФАД
Аналогичные реакции протекают в клетках крови, печени и других тканей.
Биохимические функции. Основное значение витамина В2 состоит в том, что он входит в состав флавиновых коферментов – FMN и FAD (см. гл..). Роль этих коферментов заключается в следующем:
1. ФМН и ФАД – коферменты оксидаз, переносящих электроны и Н+ с окисляемого субстрата на кислород. Таковыми являются ферменты, участвующие в распаде аминокислот (оксидазы D- и L-аминокислот), нуклеотидов (ксантиноксидаза), биогенных аминов (моно- и диаминоксидазы) и другие.
2. ФМН и ФАД – промежуточные переносчики электронов и протонов в дыхательной цепи: ФМН входит в состав I-го коплекса цепи тканевого дыхания, ФАД – в состав II-го комплекса.
3. ФАД – кофермент пируват- и α-кетоглутаратдегидрогеназных комплексов (наряду с ТПФ и другими коферментами ФАД осуществляет окислительное декарбоксилирование соответствующих кетокислот), а также единственный кофермент сукцинатдегидрогеназы (фермента цикла Кребса). Таким образом, рибофлавин принимает активное участие в работе главного метаболического пути клетки.
4. ФАД– участник реакций окисления жирных кислот в митохондриях (он является коферментом ацил-КоА-дегидрогеназы).
Гиповитаминоз. Недостаток витамина В2, как и других витаминов, проявляется слабостью, повышенной утомляемостью и склонностью к простудным заболеваниям. К специфическим проявлениям недостаточности рибофлавина относятся воспалительные процессы в слизистых оболочках. Слизистая губ и полости рта становится сухой, язык приобретает ярко-красный цвет, в углу рта появляются трещины. Отмечается повышенное шелушение эпителия кожи, особенно на лице. Конъюнктива глаза теряет блеск из-за сухости, вызываемой закупоркой слёзного канала слущивающимся эпителием. Роговица прорастает сосудами (компенсаторная реакция на недостаточность дыхательной функции роговицы) и затем мутнеет. Отмечается катаракта (помутнение хрусталика).
Гипервитаминоз не описан. При введении больших доз витамина В2 избыточного накопления флавинов в тканях не происходит, так как рибофлавин быстро выделяется с мочой.
Оценка обеспеченности организма рибофлавином. Содержание витамина В2 в крови остаётся в пределах нормы даже при выраженном гиповитаминозе. Смерть наступает ещё при достаточном уровне витамина в тканях (30% от общего количества). О степени тяжести гиповитаминоза следует судить по уровню в тканях его коферментных форм, методы определения которых достаточно трудоёмки.
Суточная потребность. Пищевые источники.
Суточная потребность в витамине – 1-3 мг.
Основными источниками рибофлавина являются печень, почки, желток куриного яйца, творог. В кислом молоке витамина содержится больше, чем в свежем. В растительных продуктах витамина В2 мало (исключение – миндальные орехи). Частично дефицит рибофлавина восполняется кишечной микрофлорой.
Хронический недостаток рибофлавина в питании существенно увеличивает риск развития рака пищевода и других органов.
Пантотеновая кислота (витамин В3).
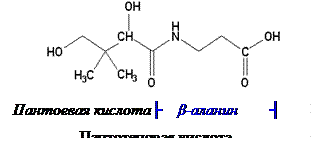 Химическое строение и свойства. Витамин В3 широко распространён в природе, отсюда и его название – пантотеновая кислота (от panthos - повсюду). Витамин открыт Р. Вильямсом в 1933 г., спустя десятилетие он уже был синтезирован химическим путём.
Химическое строение и свойства. Витамин В3 широко распространён в природе, отсюда и его название – пантотеновая кислота (от panthos - повсюду). Витамин открыт Р. Вильямсом в 1933 г., спустя десятилетие он уже был синтезирован химическим путём.
Пантотеновая кислота (пантоил-β-аланин) – светло-жёлтая маслянистая жидкость, хорошо растворимая в воде и этаноле. Спиртовое производное пантотеновой кислоты – пантенол – эффективно всасывается не только при энтеральном введении, но и при накожном его нанесении, в связи с чем пантенол получил широкое применение в дерматологии.
Метаболизм. Всасываясь на всём протяжении тонкого кишечника и в толстой кишке, в зависимости от концентрации путём простой диффузии или активного транспорта, пантотеновая кислота с током крови поступает в ткани.
Коферментными формами витамина В3, образующимися в цитоплазме клеток, являются: 4′- фосфопантетеин, дефосфо-КоА и КоА-SH. Их синтез осуществляется следующим образом:
пантотенаткиназа
 Пантотеновая кислота + АТФ 4′-фосфопантотенат
Пантотеновая кислота + АТФ 4′-фосфопантотенат
 цистеин
цистеин



 4′-фосфопантотеноилцистеин
4′-фосфопантотеноилцистеин
СО2
 4′-фосфопантетеин S-сульфопантетеин
4′-фосфопантетеин S-сульфопантетеин

 АТФ дефосфо-КоА-пирофосфорилаза
АТФ дефосфо-КоА-пирофосфорилаза
дефосфо-КоА пантетин
 АТФ дефосфо-КоА-киназа
АТФ дефосфо-КоА-киназа

 КоА-SH КоА-S-S-КоА
КоА-SH КоА-S-S-КоА
Основным продуктом распада коферментных форм витамина является пантотеновая кислота, которая выводится из организма преимущественно с мочой, часть продуктов метаболизма выделяется с калом.
Биохимические функции. Значение пантотеновой кислоты определяется исключительно важной ролью её коферментных форм в ключевых реакциях метаболизма, а также способностью производных витамина, таких как S-суль-фопантетеин, поддерживать рост бифидобактерий – важного компонента биоценоза кишечника.
Фосфопантетеин является активной субъединицей АПБ (ацил-перено-сящего белка) синтазы жирных кислот – представителя класса так называемых фосфопантетеинпротеинов.
Дефосфо-КоА – кофермент цитратлиазы и N-ацетилтрансферазы.
КоА-SH – главный кофермент клетки, с участием которого протекают многочисленные реакции метаболизма:
· Активирование ацетата (образование ацетил-КоА – СН3-СО~S-KoA). Ацетил-КоА является субстратом для синтеза жирных кислот, холестерина и стероидных гормонов, ацетоновых тел, ацетилхолина, ацетилгюкозаминов. С него начинаются реакции главного метаболического пути клетки - цикла Кребса. Ацетил-КоА принимает участие в реакциях обезвреживания (ацетилирование биогенных аминов и чужеродных соединений).
· Активирование жирных кислот (образование ацил-КоА). Ацил-КоА используется для синтеза липидов, окисляясь, он служит также источником энергии.
· Транспорт жирных кислот в митохондрии.
· Окислительное декарбоксилирование кетокислот – пировиноградной (при этом образуется ацетил-КоА)и α–кетоглутаровой (при этом образуется сукцинил-КоА, используемый в реакциях синтеза гема гемоглобина и простетической группы цитохромов).
Гиповитаминоз. Недостаточность пантотеновой кислоты практически не встречается, так как она синтезируется микрофлорой кишечника. При назначении добровольцам антивитамина проявления недостаточности пантотеновой кислоты характеризовались психоэмоциональной неустойчивостью, склонностью к обморокам, изменением походки, парастезиями, чувством жжения стоп. Синдром «жжения стоп», широко распространённый во время Второй мировой войны у военнопленных японских лагерей, хорошо излечивался назначением пантотената кальция.
Вторичная недостаточность витамина развивается при многих хронических заболеваниях, длительном применении диуретиков и алкоголизме.
Гипервитаминоз не описан, равно как токсические проявления после введения препаратов витамина.
Оценка обеспеченности организма пантотеновой кислотой. Для этой цели применяются микробиологический и хроматографический методы определения содержания пантотеновой кислоты и её производных. в крови и моче. Используется также косвенная оценка степени обеспеченности витамином В3 по количеству ацетилированной тест-дозы ароматического амина (сульфаниламида).
Суточная потребность. Пищевые источники. Пантотеновая кислота широко распространена в продуктах растительного и животного происхождения. Особенно высоко содержание витамина в пчелином маточном молочке и пивных дрожжах. Достаточно много его в печени животных, яичном желтке, гречихе, овсе, бобовых.
Суточная потребность – 10-15 мг.
Витамин РР (Витамин В5, никотиновая кислота, никотинамид, ниацин). Антипеллагрический витамин.
Химическое строение и свойства. Витамин РР был выделен К. Эвельгеймом в 1937 г., его введение предохраняло от заболевания пеллагрой или излечивало её. «РР» означает п ротиво п еллагрический (preventive rellagra).
Никотиновая кислота является пиридин-3-карбоновой кислотой, никотинамид –её амидом. Оба соединения в организме легко превращаются друг в друга и поэтому обладают одинаковой витаминной активностью.
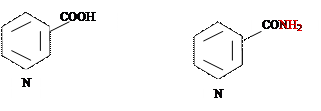 |
Никотиновая кислота Никотинамид
Витамин РР плохо растворяется в воде, но хорошо в водных растворах щелочей.
Метаболизм. Поступающий с пищей витамин РР быстро всасывается в желудке и кишечнике в основном путём простой диффузии. С током крови никотиновая кислота легко попадает в печень и другие органы, несколько медленнее проникает в них никотинамид. В тканях оба соединения преимущественно используются для синтеза коферментных форм – НАД и НАДФ. Коферменты через биомембраны не проникают.
Биосинтез НАД осуществляется в 2 этапа.
1 этап протекает в цитоплазме с помощью фермента никотинмононуклеотид-пирофосфорилазы (источником синтеза фосфорибозилпирофосфата служит рибозо-5-фосфат, образующийся в пентозофосфатном пути окисления глюкозы):
Фосфорибозилпирофосфат РPi
 пирофосфорилаза
пирофосфорилаза
Никотинамид никотинамид-мононуклеотид
2 этап продолжается в ядре клетки, реакция катализируется НАД-пирофосфорилазой:
АТФ ФФн
 пирофосфорилаза
пирофосфорилаза
2. Никотинамид-мононуклеотид НАД+
Синтез кофермента может осуществляться также митохондриями.
НАДР образуется из НАД в цитоплазме клетки с участием фермента НАД-киназы:
 АТФ AДФ
АТФ AДФ
НАД- киназа
НАД+ НАДФ+
Часть никотинамидных коферментов синтезируется в организме животных из триптофана. Однако этот путь, в который вовлекается до 2% метаболического пула триптофана, значительно уступает по эффективности первому (т.е. из прямого витаминного предшественника).
Распад нуклеотидов катализируется ферментами гликогидролазами (соответственно НАД–гликогидролаза и НАДФ–гликогидролаза), расщепляющими гликозидные связи с образованием никотинамида и АДФ-рибозы. Затем никотинамид окисляется и продукты его окисления (преобладает N–метилникотин-амид) выводятся с мочой.
Биохимические функции. Почти весь имеющийся в клетках и жидких средах организма витамин РР представлен в виде никотинамида, включённого в состав коферментов – НАД и НАДФ. Поэтому значение ниацина определяется ролью этих коферментов, которая является чрезвычайно многогранной:
1. НАД - кофермент дегидрогеназ, участвующих в реакциях окисления глюкозы, жирных кислот, глицерола, аминокислот; является коферментом дегидрогеназ цикла Кребса (исключая сукцинатдегидрогеназу). В этих реакциях кофермент выполняет функцию промежуточного акцептора электронов и протонов.
2. НАД – переносчик протонов и электронов в дыхательной цепи митохондрий (от окисляемого субстрата к первому комплексу цепи тканевого дыхания).
3. НАД – субстрат ДНК-лигазной реакции при синтезе и репарации ДНК, а также субстрат для синтеза поли-АДФ-рибозы в поли-(АДФ)-рибозилировании белков хроматина.
4. НАДФН – донор водорода в реакциях синтеза жирных кислот, холестерина, стероидных гормонов и некоторых других соединений.
5. НАДФН – компонент монооксигеназной цепи микросомного окисления, выполняющей функцию детоксикации антибиотиков и других чужеродных веществ.
6. НАД и НАДФ – аллостерические регуляторы ферментов энергетического обмена, в частности, ферментов цикла Кребса, а также реакций новообразования глюкозы (глюконеогенеза).
Никотинамид и N-метилникотинамид (метаболит никотинамида) являются участниками процесса метилирования т-РНК и белков.
Гиповитаминоз. Характерным признаком недостаточности ниацина является симптомокомплекс «трёх Д»: дерматит, диарея, деменция. Так проявляется заболевание пеллагрой (от ит. pelle agra –шершавая кожа). Болезнь, свирепствовавшая в Испании и Португалии в XVI веке, быстро распространилась по странам Средиземноморского после того, как там стали интенсивно возделывать кукурузу. Поскольку кукуруза намного продуктивнее, чем прочие зерновые культуры, она завоевала огромную популярность и постепенно стала основным продуктом питания для бедных слоёв населения. Однако в кукурузе витамин РР содержится в трудно усвояемой для человека форме, она бедна триптофаном, из которого способен синтезироваться этот витамин..
В основе заболевания лежит нарушение пролиферативной активности и энергетики клеток.
Дерматит чаще всего отмечается на открытых участках кожи, которая под действием солнечных лучей краснеет, покрывается пигментными пятнами (в виде крыльев бабочки) и шелушится. Язык становится ярко-красным и болезненным, утолщается, на нём появляются трещины (глоссит). Слизистые оболочки полости рта (стоматит, гингивит) и кишечника воспаляются, затем изъязвляются. Расстройство пищеварения проявляется тошнотой, отсутствием аппетита, болями в животе, поносами. Нарушается функция периферических нервов и центральной нервной системы. Появляется головокружение, головные боли. Апатия сменяется депрессией. Тугодумие – вплоть до умственной отсталости – тоже проявление болезни. Развиваются психозы, психоневрозы, в тяжёлых случаях отмечаются галлюцинации.
Симптомы пеллагры чаще наблюдаются лиц с недостатком белка в диете. Объясняется это тем, что животные белки содержат оптимальное количество аминокислоты триптофана, витамина В6 и некоторых других, необходимых для биосинтеза ниацина.
Гипервитаминоз. У млекопитающих состояния гипервитаминоза РР вызвать не удалось. Данные о способности ниацина накапливаться в тканях отсутствуют. Избыток никотиновой кислоты быстро выводится с мочой.
Оценка обеспеченности организма витамином РР. Обеспеченность организма ниацином достаточно хорошо характеризуется величиной экскреции основных продуктов его катаболизма – N-метилникотинамида и метил-2-пиридон-5-карбоксиамида. В нормальных физиологических условиях концентрация выводимых с мочой метаболитов никотиновой кислоты и никотинамида невелика, но резко возрастает при их избыточном поступлении в организм. Определение количественного содержания N-метилникотинамида и его пиридонов в моче после применения нагрузочных доз витамина РР до настоящего времени служит единственным критерием обеспеченности организма этим витамином. Таким критерием не могут быть уровни самого витамина РР или его коферментных форм в крови, так как даже при тяжёлой пеллагре их содержание мало отличается от здоровых лиц.
Суточная потребность. Пищевые источники.
Суточная потребность составляет 20-25 мг.
Источником витамина являются животные (особенно печень, мясо) и многие растительные продукты, в первую очередь, рис, хлеб, картофель. Молоко и яйцо содержат следы ниацина. Правда, витамин РР способен синтезироваться клетками организма из триптофана, но этот процесс малоэффективен – из десятков молекул триптофана образуется только одна молекула витамина. Тем не менее, продукты, богатые этой аминокислотой (молоко и яйцо) могут компенсировать недостаточное поступление никотинамида с пищей.
Витамин В6 (Пиридоксин). Антидерматитный витамин.
Химическое строение и свойства. Витамин В6 включает группу трёх природных производных пиридина, обладающих одинаковой витаминной активностью: пиридоксина, пиридоксаля, пиридоксамина, отличающихся друг от друга наличием спиртовой, альдегидной или аминогруппы. Витамин В6 был открыт в 1934 г. Дьёрди и вскоре синтезирован химически.
Пиридоксин хорошо растворяется в воде и этаноле, устойчив в кислой и щелочной среде, но легко разрушается под действием света при рН=7,0.
Метаболизм. Всосавшись в тонком кишечнике, все формы витамина С током крови разносятся к тканям и, проникая в клетки, фосфорилируются с участием АТФ и пиридоксалькиназ. Коферментные функции выполняют 2 фосфорилированных производных пиридоксина: придоксальфосфат и пиридоксаминфосфат.
 |
Распад коферментов осуществляется путём дефосфорилирования и окисления в тканях. Основным продуктом катаболизма является 4-пиридоксиловая кислота, которая экскретируется с мочой.
Биохимические функции. Витамин В6 часто называют «королём обмена аминокислот»; вместе с тем его коферментные формы участвуют в реакциях, катализируемых почти всеми классами ферментов. Механизм действия всех пиридоксальфосфат-зависимых ферментов сходен: 1/ вначале образуются шиффовы основания между аминокислотой и коферментом (рис), при этом нитрофильный азот пиридинового кольца действует как своеобразный электронный сток, уводя электроны от аминокислоты и стабилизируя промежуточный интермедиат – карбанион; 2/ будучи неустойчивыми, шиффовы основания (альдимины) далее модифицируются в процессах трансаминирования, декарбоксилирования, изомеризации и многих других превращениях боковой цепи аминокислот.
Коферментные формы витамина В6 входят в состав следующих ферментов:
1. Аминотрансфераз аминокислот, катализирующих обратимый перенос NH2-
группы от аминокислоты на α-кетокислоту. В этой реакции образуются новые α-кетокислоты и заменимые аминокислоты.
2. Декарбоксилаз аминокислот, отщепляющих карбоксильную группу аминокислот, что приводит к образованию биогенных аминов (гистамина, серотонина, ГАМК и других), а также моноаминоксидаз, гистаминазы (диаминооксидаза ) и аминотрансферазы ГАМК, обезвреживающих (окисляющих) биогенные амины.
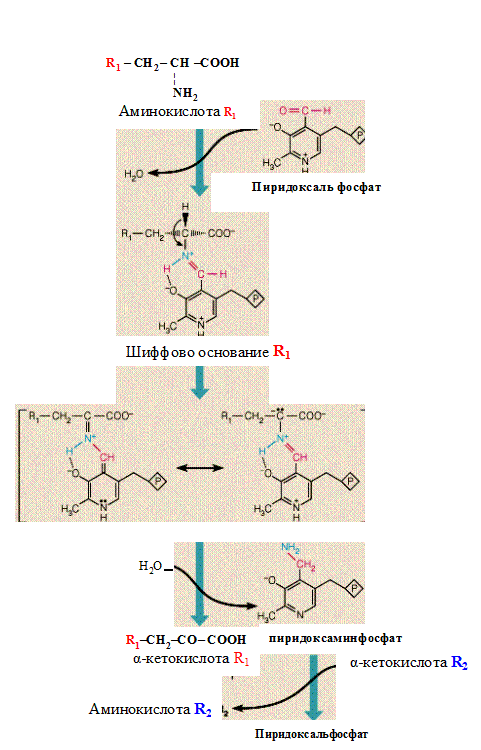
Рис. Механизм действия коферментов пиридоксина.
3. Изомераз аминокислот, с помощью которых организм разрушает D-аминокислоты (в состав тканевых белков млекопитающих входят L-аминокислоты).
4. Аминотрансфераз иодтирозинов и иодтиронинов, участвующих в синтезе гормонов щитовидной железы и распаде этих гормонов в периферических тканях.
5. Синтазы δ–аминолевуленовой кислоты, участвующей в биосинтезе гема гемоглобина и других гем-содержащих белков (из глицина и сукцинил~ КоА).
6. Кинурениназы и кинуренинаминотрансферазы, обеспечивающих синтез витамина РР из триптофана.
7. Цистатионинсинтазы (а) и цистатионинлиазы (б) – ферментов, катализирующих синтез и распад цистатионина в следующих реакциях:
СН2-SH CH2-OH CH2 - S - CH2 Н2О NH3 CH3 CH2-SH
 | | H20 | | | |
| | H20 | | | |


|
|
 | | | | (б) | |
| | | | (б) | |
CH-NH2 COOH (а) CH-NH2 COOH C=О COOH
| | |
 2015-10-16
2015-10-16 1291
1291
