Исходные данные:
- состав газового фонтана СН4 – 74 об.%, С4Н10 – 7 об.%, С22Н6– 10 об.%, СО – 3 об.%, CO2 – 6 об.%;
- dу = 220 мм;
- Нф = 45 м;
- 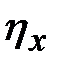 = 0,055;
= 0,055;
- b = 0,75;
- Kи = 0,55.
1. Дебит газового фонтана (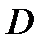 , млн. м3/сутки):
, млн. м3/сутки):
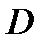 = 0,0025×
= 0,0025× 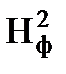 = 0,0025× 452 =5,0625 млн. м3/сутки
= 0,0025× 452 =5,0625 млн. м3/сутки
Секундный расход газа составит V г = 5,0625 ×106/ (24×60×60) = 23,9м3/с.
2. Режим истечения газовой струи:
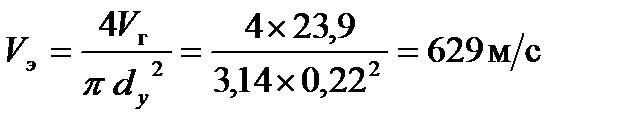 ,
,
где V г−секундный расход газа, м3/с,
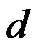 у −диаметр устья скважины, м.
у −диаметр устья скважины, м.
Скорость звука в метане (V0)составляет 430 м/с. Расcчитанная скорость истечения газовой струи не превышает скорость звука. Режим истечения газа – турбулентный.
3. Расчет адиабатической и действительной температуры процесса горения.
Рассчитаем теплоту сгорания (− 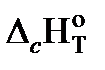 = Qн) метана, этана и бутана, опираясь на первое следствие из закона Гесса. Запишем уравнения реакции их окисления:
= Qн) метана, этана и бутана, опираясь на первое следствие из закона Гесса. Запишем уравнения реакции их окисления:
СН4(г)+ 2(О2 + 3,76N2) = СО2(г) + 2Н2О(г) + 2×3,76N2
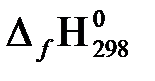 , кДж/моль −74,85 0 −393,51 −241,81 0
, кДж/моль −74,85 0 −393,51 −241,81 0
Согласно первому следствию из закона Гесса, теплота сгорания метана будет равна:
Qсн=−{ 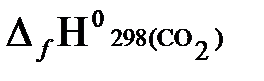 +2
+2 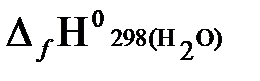 −
− 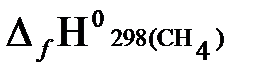 } =
} =
= −{(−393,51) + 2(−241,81) − (−74,85)} = 802,29 кДж/моль.
Значение низшей теплоты сгорания 1 м3 метана рассчитаем по формуле:
Qнс, об = Qнс×1000/24,45,
где 24,45 л − объем одного моля газа при Т = 298 K.
Отсюда низшая теплота сгорания 1 м3 метана будет равна:
Qнс, об(СН4) = 802,29×1000 / 24,45 = 32813,5 кДж/м3.
· для бутана
C4H10+ 6.5О2 +6.5×3.76N2 = 4СО2(г)+ 5Н2О(г)+ 6.5×3.76N2
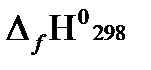 , кДж/моль: −126,15 0 -393.51 −241.81
, кДж/моль: −126,15 0 -393.51 −241.81
Согласно первому следствию из закона Гесса, теплота сгорания бутана будет равна:
Qсн=−{4 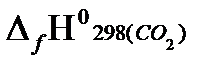 +5
+5 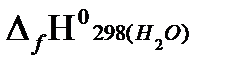 −
− 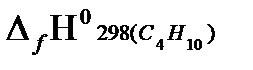 } =
} =
= - {4(−393.51)+5(−241.81)−(−126,15)} = 2656,89 кДж/моль.
Значение низшей теплоты сгорания 1 м3 бутана рассчитаем по формуле:
Qнс, об = Qнс×1000/24,45,
где 24,45 л - объем одного моля газа при Т=298 К.
Отсюда низшая теплота сгорания 1 м3 бутана будет равна:
Qнс, об(СН4) = 2657,1 ×1000 / 24, 45 = 108666,26 кДж/м3.
· для этана:
С2Н6(г)+3,5(О2+3,76N2)=2CO2+3H2O+3.5×3,76N2
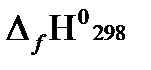 , кДж/моль: −84.67 0 −393.51 -241.81
, кДж/моль: −84.67 0 −393.51 -241.81
Согласно первому следствию из закона Гесса, теплота сгорания этана будет равна:
Qсн=−{ 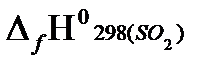 +
+ 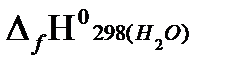 −
− 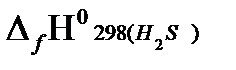 } =
} =
= - {2(−393.51)+3(−241.81)−(−84,67)} = 1427,81 кДж/моль.
Значение низшей теплоты сгорания 1 м3 этана рассчитаем по формуле:
Qнс, об = Qнс×1000/24,45,
где 24,45 л - объем одного моля газа при Т=298 К.
Отсюда низшая теплота сгорания 1 м3 этана будет равна:
Qнс, об(СН4) = 1427,81 ×1000 / 24, 45 = 58397,1 кДж/м3.
· Для оксида углерода
СО+0,5(О2+3,76)=СО2+0,5×3,76N2
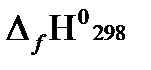 , кДж/моль: 0 -393.51 0
, кДж/моль: 0 -393.51 0
Согласно первому следствию из закона Гесса, теплота сгорания бутана будет равна:
Qсн=−{ 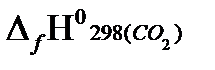 }== - {(−393.51) }=393,51 кДж/моль.
}== - {(−393.51) }=393,51 кДж/моль.
Значение низшей теплоты сгорания 1 м3 оксида углерода рассчитаем по формуле:
Qнс, об = Qнс×1000/24,45,
где 24,45 л - объем одного моля газа при Т=298 К.
Отсюда низшая теплота сгорания 1 м3 оксида углерода будет равна:
Qнс, об(СН4) = 393,51 ×1000 / 24, 45 = 16094,5 кДж/м3.
Поскольку в 1 м3 исходной газовой смеси содержится 74 об. % метана, 7 об. % бутана, 10 об. % этана, то общая теплота сгорания 1 м3 смеси составит
Qсн, об = 32813,5 × 0,74 +58397,1 × 0.1 + 2656,89 × 0,07+16094,5×0,03
=30790,5 кДж.
Определим объем (V) и число молей (ν) продуктов горения, образовавшихся при сгорании исходной смеси, содержащей 74 об.% СН4, 7 об.% С4Н10,, 10 об.% С2Н6,3 об.% СО, используя приведённые выше химические уравнения реакций их горения. Учтём также, что смесь в соответствии с заданием содержит дополнительно, 6 % СО2. 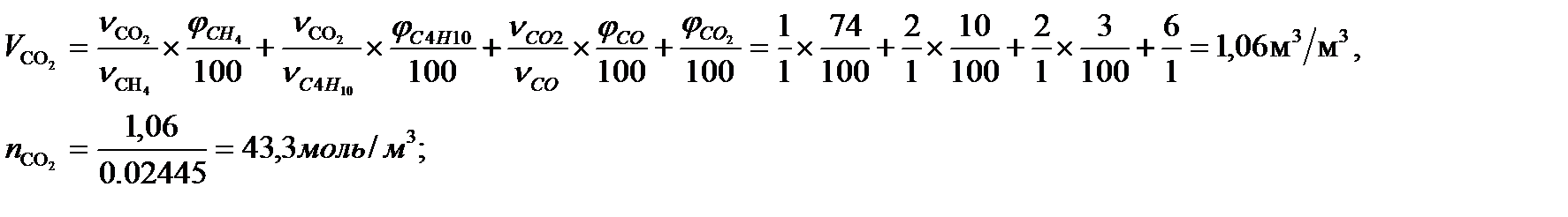
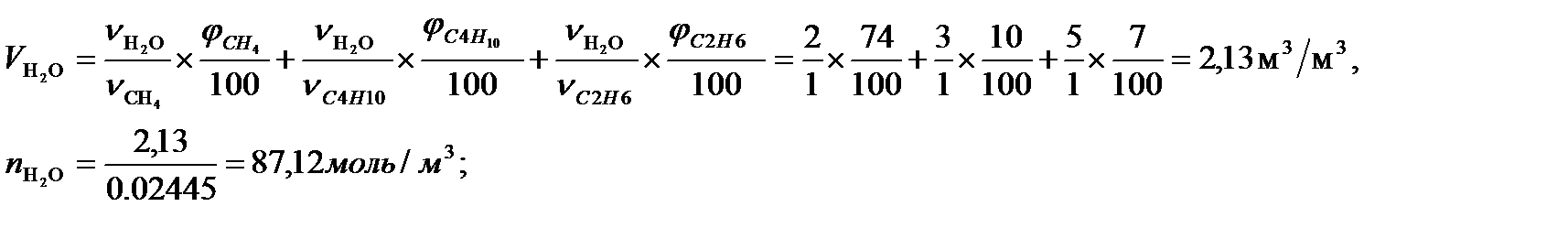
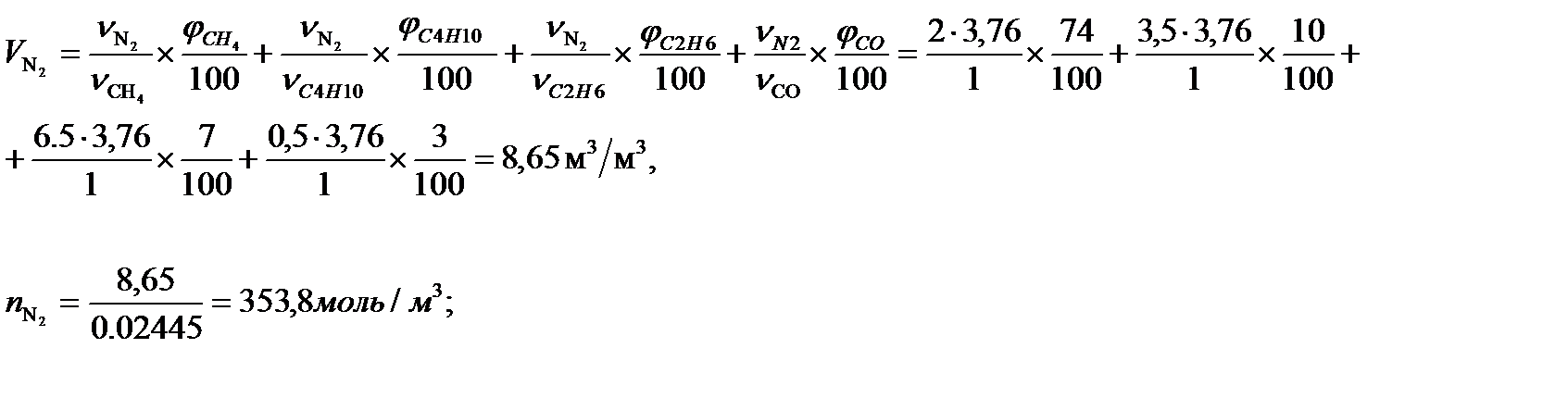
Суммарный объем продуктов горения составит:
Vпг = 1,06 + 2,13 + 8,65=11,86 м3/м3 или 485,07 моль/м3.
Адиабатическая температуры горения:
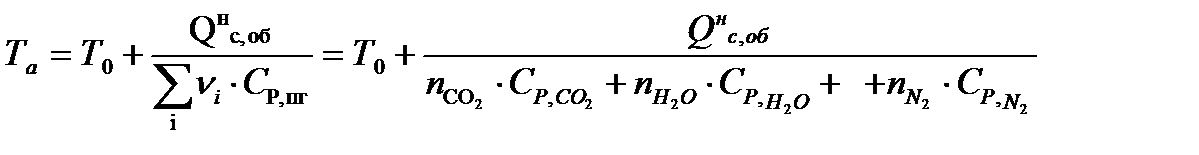
Для расчетов воспользуемся следующими средними значениями теплоемкостей для температурного диапазона 298−2000 K
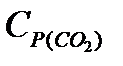 =53,14;
=53,14; 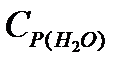 =42,34;
=42,34; 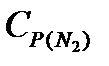 =32,76Дж/моль.K.
=32,76Дж/моль.K.
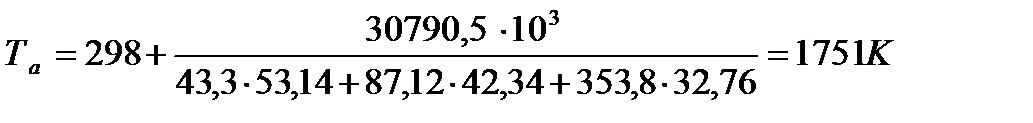 .
.
Действительная температура горения всегда ниже адиабатической, так как часть тепла теряется с излучением. При расчете действительной температуры горения учитываются потери тепла в результате химического недожога в зоне горения, когда образуются продукты неполного сгорания (СО, С, 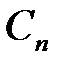
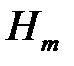 и др.) и потери тепла за счет излучения факела пламени:
и др.) и потери тепла за счет излучения факела пламени:
Молекулярная масса горючего газа, содержащего метан, бутан, этан, будет равна:
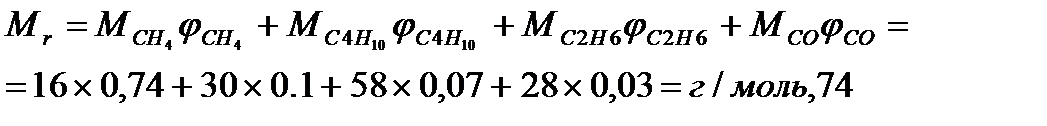
Коэффициент теплопотерь за счёт излучения пламени фонтана составит:
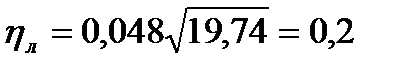
Тогда для общих теплопотерь будет равна:
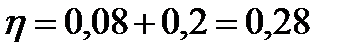 .
.
Действительная температура горения газового фонтана будет равна:
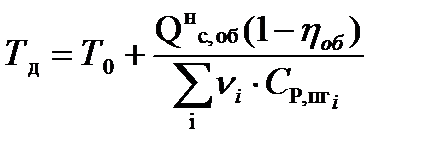 (30)
(30)
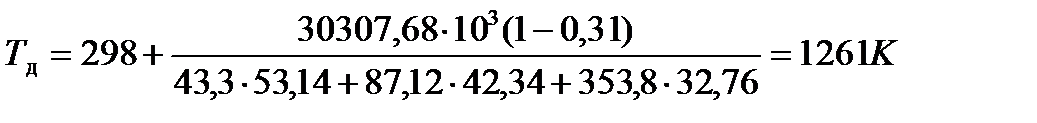 .
.
4. Величина облученности от факела пламени горящего фонтана в зависимости от расстояния до устья скважины:
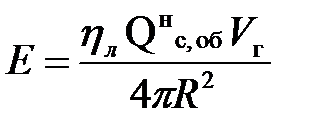
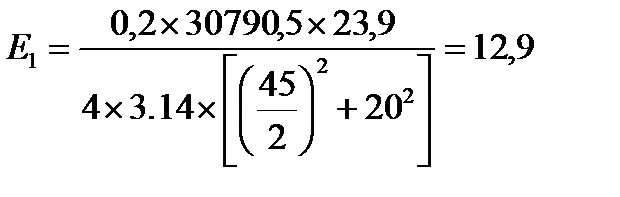 кВт/м2
кВт/м2
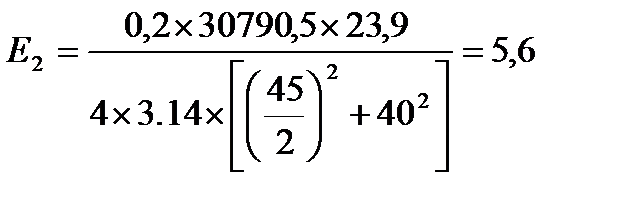 кВт/м2
кВт/м2
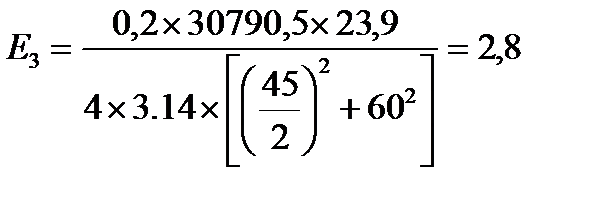 кВт/м2
кВт/м2
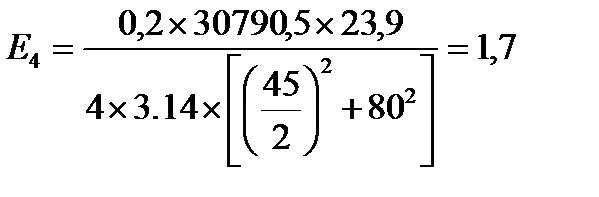 кВт/м2
кВт/м2
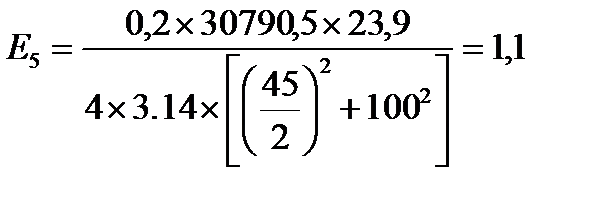 кВт/м2
кВт/м2
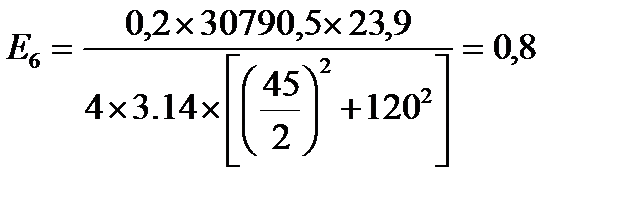 кВт/м2
кВт/м2
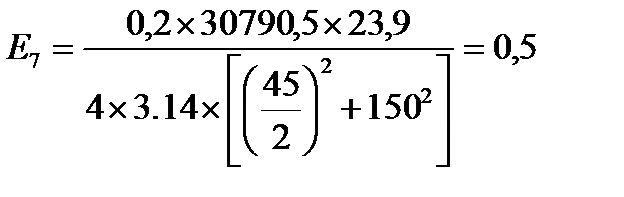 кВт/ м2
кВт/ м2
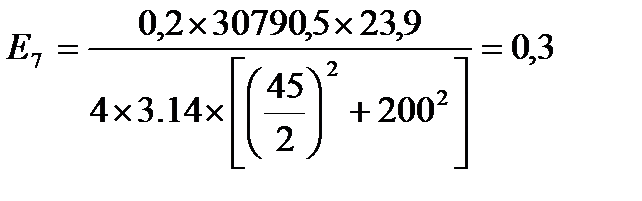 кВт/м2
кВт/м2
Рассчитанные значения облученности сведем в табл. 1
Таблица 1
Величина облученности от факела газового фонтана в зависимости
от расстояния до устья скважины
| L,м | ||||||||
| Е, кВт/м2 | 12,9 | 5,6 | 2,8 | 1,7 | 1,1 | 0,8 | 0,5 | 0,3 |
Зависимость Е = f (L) в графической форме представлена на рис. 4.
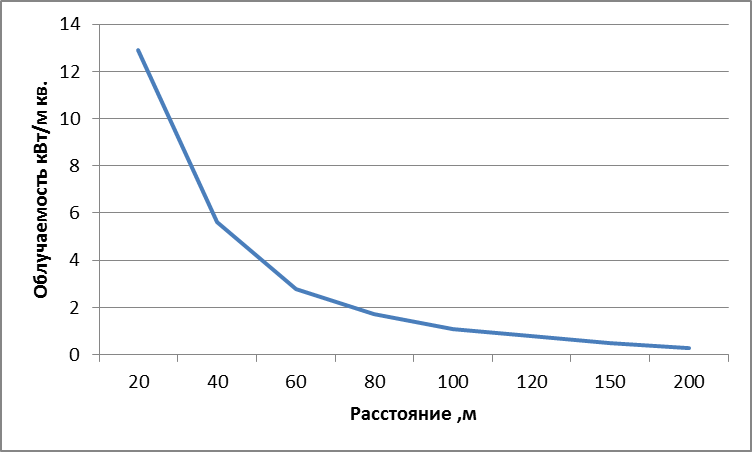
Рис. 4. Зависимость изменения облученности, создаваемой факелом
пламени газового фонтана, от расстояния до устья скважины
Построенный график можно использовать для определения границ локальных зон теплового воздействия факела горящего фонтана, на которых уровень облученности составляет 1,6; 4,2 и 14 кВт/м2, путем нахождения расстояния от точки, имеющей соответствующую облученность, до устья скважины.
Например, при тушении пожара газового фонтана без теплоотражательного костюма под защитой водяных струй граница зоны теплового воздействия находится на расстоянии:
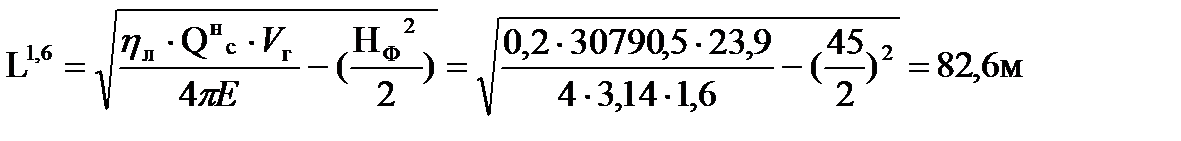
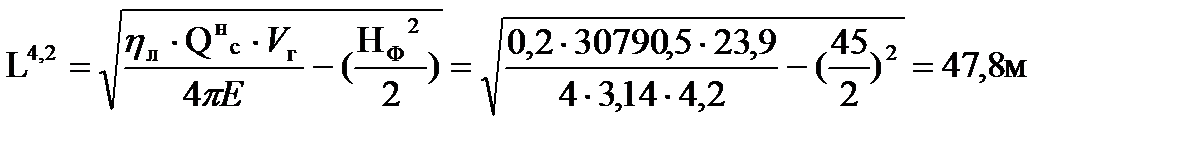
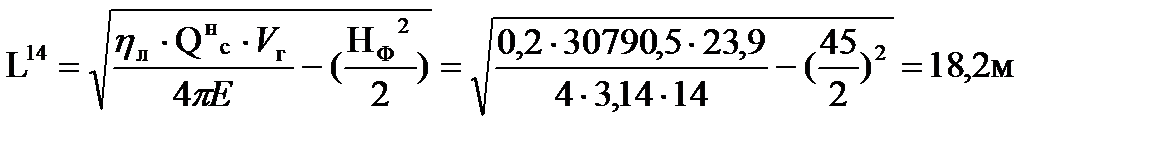
Таким образом, расстояние до соответствующих локальных зон теплового воздействия составляют соответственно 46; 28 и 14 м от устья скважины.
5. Определение теоретического расхода воды на тушение газового фонтана:
g вт = 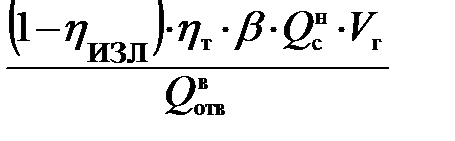 .
.
Коэффициент h т в свою очередь рассчитывается из соотношения
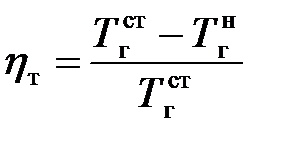 .
.
Для определения этого коэффициента необходимо рассчитать действительную температуру горения стехиометрической смеси горючих газов с воздухом (при a=1) 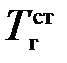 и температуру горения при концентрации горючей смеси, равной нижнему концентрационному пределу
и температуру горения при концентрации горючей смеси, равной нижнему концентрационному пределу  .
.
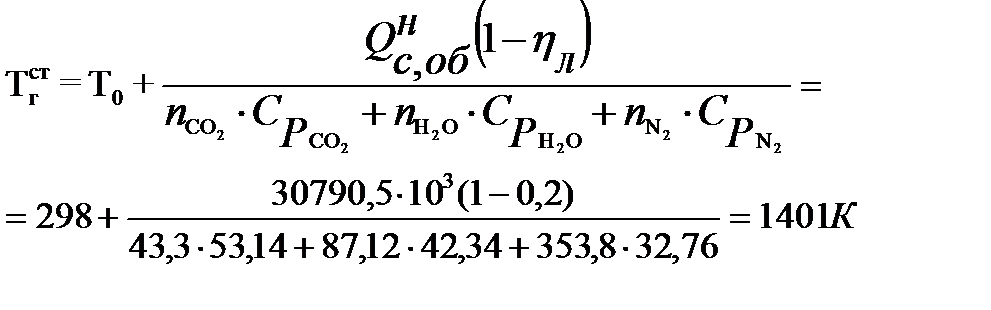
.
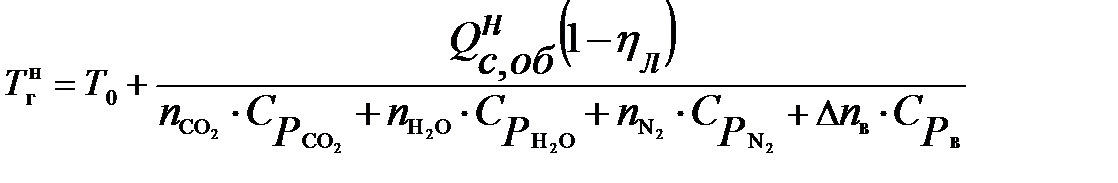 .
.
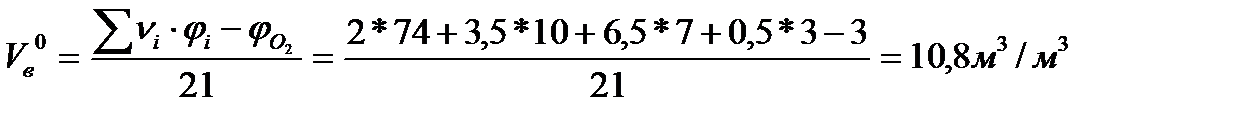 .
.
Нижний концентрационный предел для многокомпонентной газовой смеси:
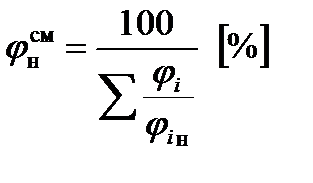 ,
,
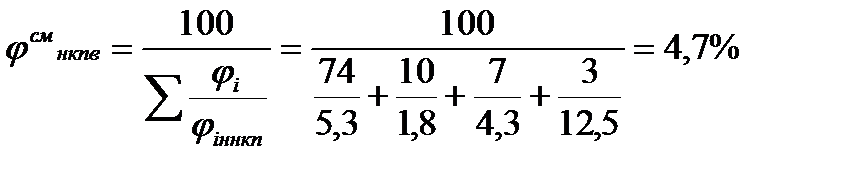
Отсюда 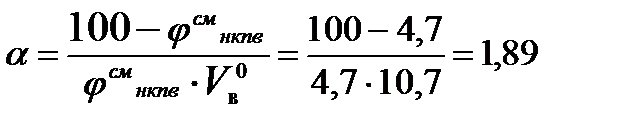
Тогда D V в = 10,7 (1,89 - 1) =9,52 м3/м3
или 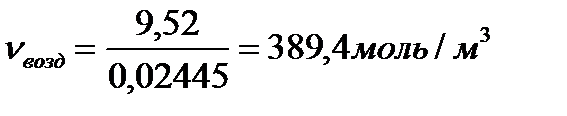
Среднее значение теплоёмкости воздуха в интервале температур 298-2000 К составляет 32,3 Дж/ (моль К).
Отсюда:
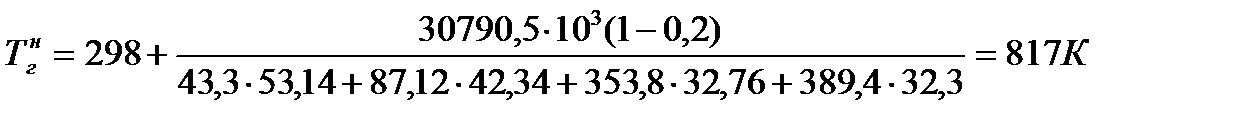
Определим коэффициент h т:
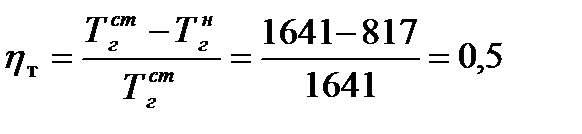
Расход воды, требуемый для прекращения горения газового фонтана:
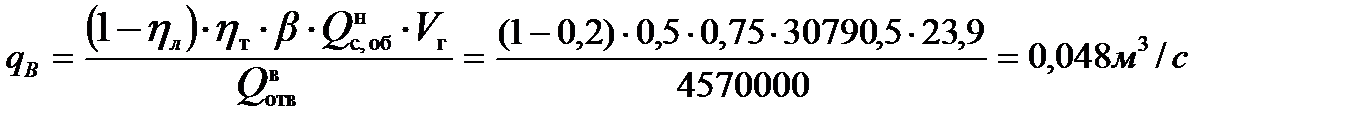
С учетом коэффициента использования воды, равного 0,55, ее расход составит:
g впр = 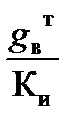 =
= 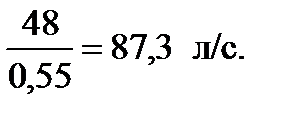
При подаче стволов Б с расходом gств = 3,7 л/с требуемое их количество Nств составит: 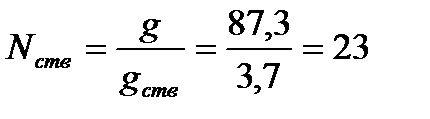 шт.
шт.
При подаче стволов А с расходом gств = 7,4 л/с:
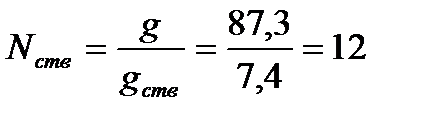 шт.
шт.
 2015-10-13
2015-10-13 2810
2810








