Марганец находится в VI группе периодической системы элементов Менделеева, порядковый номер 25, относительная атомная масса 54,938, атомный радиус 0,13 нм.
Размеры ионных радиусов зависят от валентности марганца в соединениях и составляют, нм: Mn(II) – 0,091; Mn(IV) – 0,052;Mn(VII) – 0,046.
В отличии от атома железа, имеющего на 3d-уровне шесть электродов, при 4s2, для изолированного марганца характерно заполнение 4s2, при наличии только пяти электронов на том же 3d-уровне. Особенности энергетической системы электронов изолированного атома марганца обусловливают и аномальные свойства его как металла. Марганец – это полиморфный металл, достоверные температуры полиморфных превращений следующие
| 1000К 1360К 1410К 1517±5К |
| α–Mn → β–Mn → γ–Mn → δ –Mn |
Температуру превращения δ–Mn→MnЖ обычно принимают равной 1517 К. Превращения сопровождаются объемными изменениями
β–Mn → γ–Mn (+ 0,77%): при затвердевании составляет 4,5%.
Динамическую вязкость жидкого марганца в тигле из Al2O3 в атмосфере водорода при температуре до 1770К можно рассчитать по выражению: lg η = 46513/Т – 1,716. Зависимость плотности жидкого марганца от температуры описывается выражением dMn = 6,71 – 2,22·10-4Т
Коэффициент самодиффузии DMn атомов марганца (по П.В. Гельду) может быть найден DMn = 6,46 · 10-16/Тd1/3η.
С повышением температуры DMn монотонно возрастает от 0,38 · 10-3 при 1280°С до 0,78 · 10-3 м2/с при 1720°С.
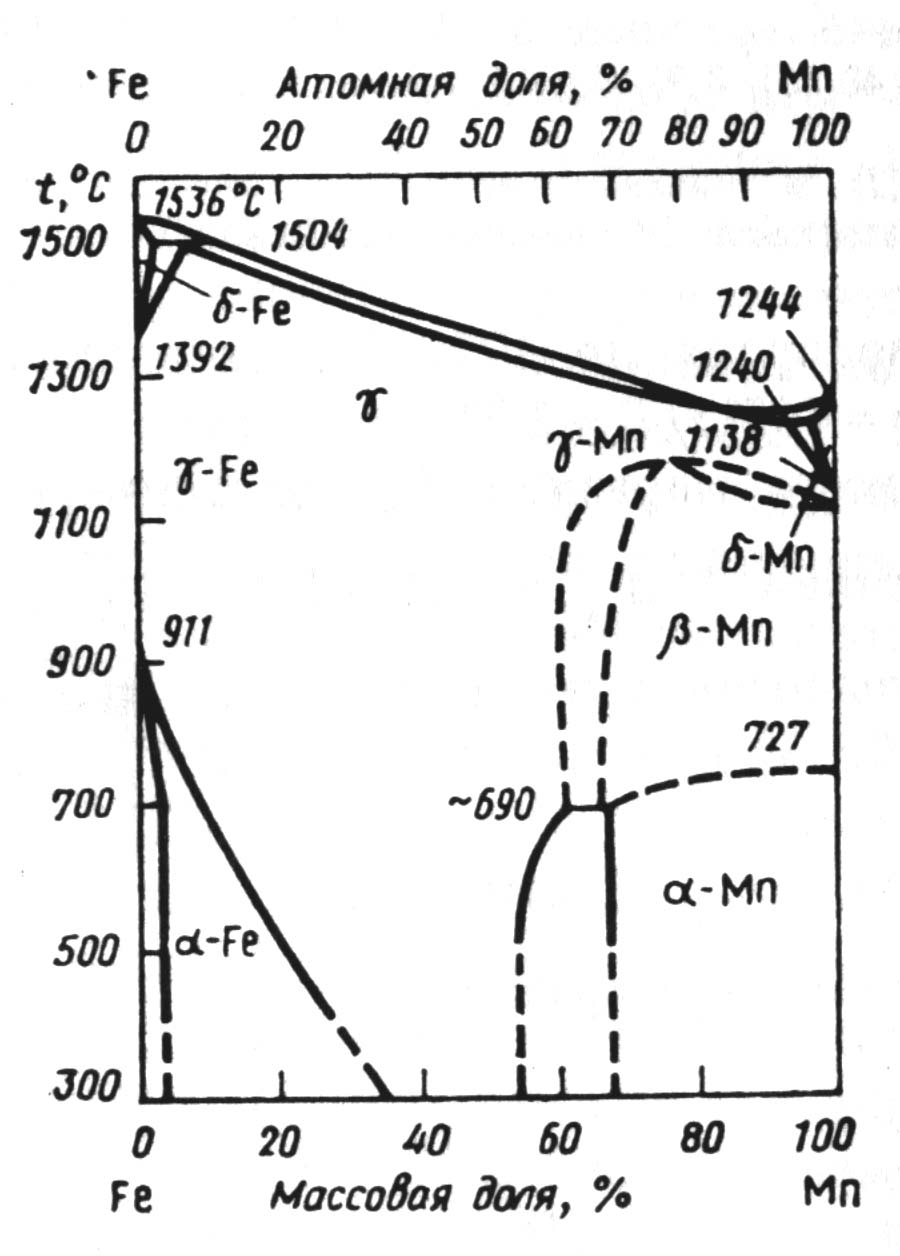
Система Mn – Fe, из представленной на рис. 1.1 диаграммы следует, что существует большая область твердого раствора на основе γ–Fe и γ–Mn. Растворы α–Mn и β–Mn появляются при концентрации Mn ≥68-70% и более. Долгое время оставалась малоизученной область δ-Mn, и только в последнее время установлено, что она значительно шире по концентрации чем считалось ранее. Наиболее низкая температура плавления сплавов в системе Mn – Fe составляет 1232°С при атомном содержании марганца 87% [3].
При 1300К активность железа и марганца до концентрации 50% изменяется по прямой линии и подчиняется закону идеальных растворов. Интегральная энтальпия смешения достигает максимума –8360 Дж/моль при хMn = 0,7.
Система Mn-С. Уточненная диаграмма равновесного состояния системы Mn-С представлена на рисунке 2.2. В указанной системе идентифицированы следующие карбиды: Mn23С6 (5,4% С), Mn3С (6,77% С), Mn5С2 (8,03% С) и Mn7С3 (8,57% С). На рисунке 2.2 представлены области существования фаз, твердых растворов углерода в марганце, базирующихся на структурах α–Mn, β–Mn, γ–Mn, δ –Mn и карбидной фазы ε с широкой областью гомогенности. Кривая ликвидус на диаграмме состояния На основании выполненных исследований состав системы Mn-С в координатах концентрации углерода (ат. доли) – температура может быть выражена уравнением:
Рис. 2.1 − Диаграмма состояния системы Fe-Mn
lg[C] = -375,8/Т – 0,347. (2.1 )
Зависимость ∆G0Т для реакции растворения графита в жидком марганце:
С Т + Mn ж = [C]Mn (2.2)
имеет вид ∆G0Т = 17600 – 25,64Т, Дж/моль, а функция ln хС (1/Т) описывается выражением lg хС = -413,96/Т – 0,314.
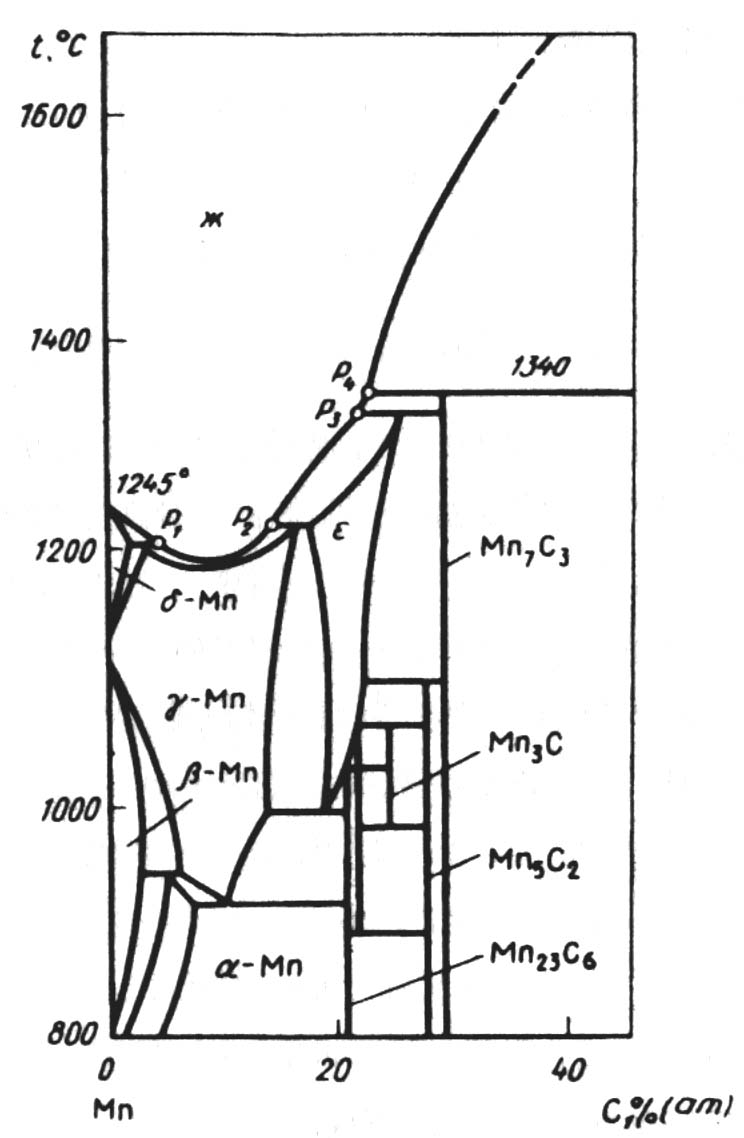
Рис. 2.2 − Диаграмма равновесного состояния системы Mn-С
Активность марганца в сплавах системы Mn-С при 1400°С и х < 0,15 имеет положительные отклонения от законов Рауля, в интервале концентраций хС > 0,15 до хСнас = 0,269 – отрицательные. В координатах lgγ Mn – х2С линия имеет перегиб при хС = 0,12, соответствует границе между твердым γ- и ε-фазами по диаграмме состояния Mn-С.
В тройной системе Mn-Fe-С возможно существование комплексных железомарганцевых карбидов. Кристаллическая структура последних определяется содержанием марганца и железа в металлической части карбидов. В двойных карбидах тройной системы Mn-Fe-С возможно сохранение кристаллической решетки карбидов Mn23С6 и Mn7С3 только до определенного содержания железа, атомы которого изоморфно защищают атомы марганца [3].
Система Mn-Si. Диаграмма состояния системы (рисунок 2.3) построена с учетом существования силицидов Mn6Si, Mn9Si2, Mn3Si, Mn5Si2, Mn5Si3, MnSi и Mn11Si19, которые ранее или не были известны, или соответствовали другому составу. Так, силицид Mn11Si19 находится в области составов, в которой раньше находился MnSi2.
Плотность жидких сплавов системы Mn-Si с повышением концентрации уменьшается. При 1773К и содержании кремния 30% (ат.) и 60% (ат.) плотность сплава составляет 5,31 и 4,35 г/см3 (5,82 и 2,52 г/см3 для чистых марганца и кремния). Высокая степень микронеоднородности расплавов, особенно в области концентрации кремния 25-70%, является следствием направленного взаимодействия между атомами марганца, железа и кремния.
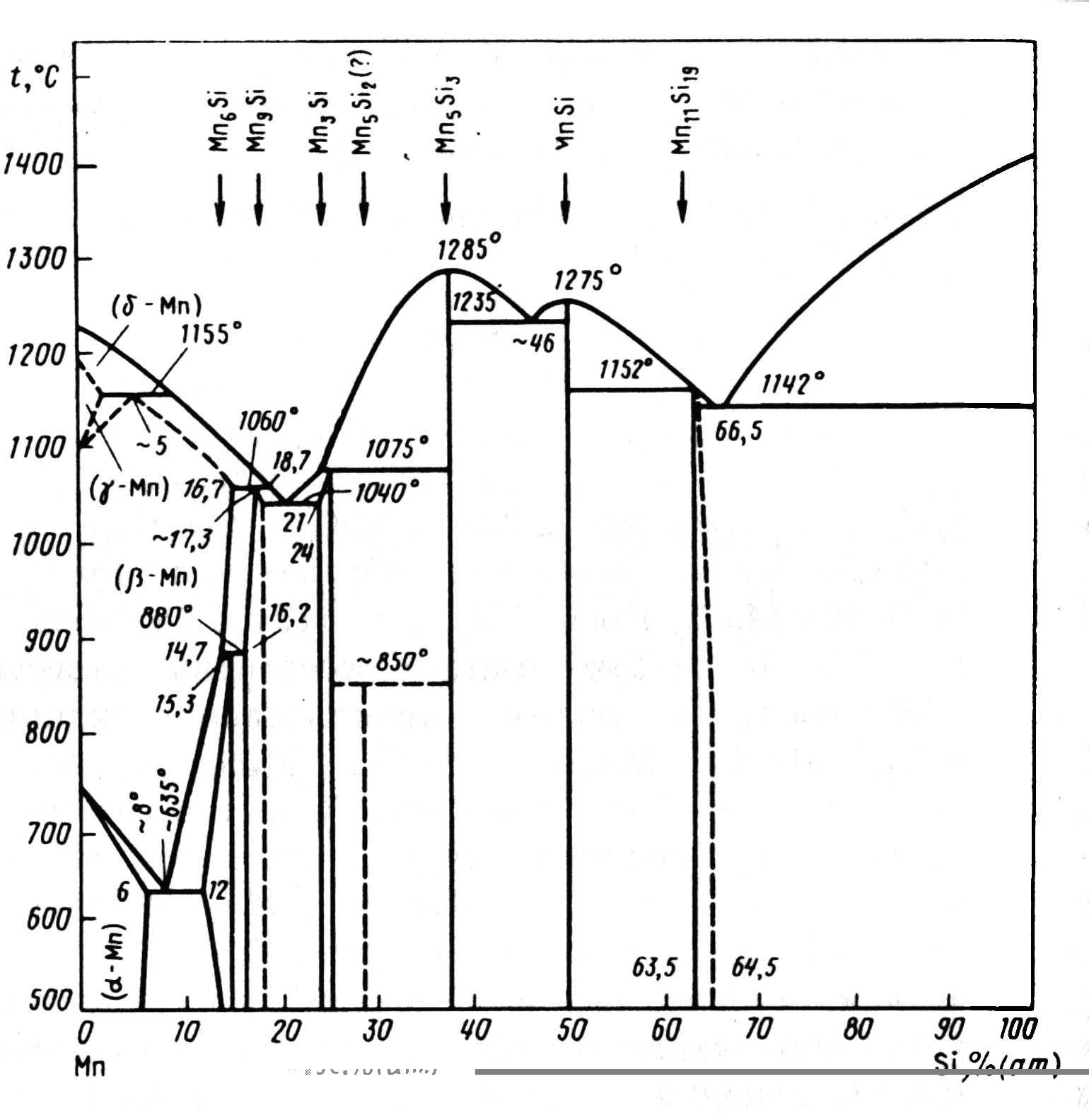
Рис. 2.3 − Диаграмма равновесного состояния системы Mn-Si
Наличие в расплавах Mn-Si существенно ковалентных связей подтверждается и характером растворимости водорода в этих сплавах.
Концентрационные зависимости растворимости и коэффициент активности водорода, а также изменение энтальпии и энтропии растворения водорода в сплавах имеют экстремальный вид с пологим максимумом, соответствующим атомному содержанию кремния 40-70%.
В сплавах с недостатком или избытком (относительно 63,1% ат) кремния появляются чистые фазы MnSi и Si соответственно. Других структур, например Mn11Si19 (MnSi1,727), Mn26Si45 не обнаружено. Активность марганца и кремния в расплавах системы Mn-Si, зависит от состава сплава и температуры. Энергия образования твердых сплавов имеет минимальное значение для соединения Mn5Si3 при хSi = 0,375, т.е. смещена от хSi = 0,3 в сторону меньших значений. Такое смещение энергии Гиббса подтверждено и для жидких сплавов системы Mn-Si. При 1623К растворы являются регулярными до хSi = 0,38, что соответствует на диаграмме состояния соединению Mn5Si3. При 1673К значению хSi = 0,38 соответствует точка перегиба. При большей концентрации кремния (хSi = 0,7) зависимость lg γMn = f (xSi2) имеет линейный характер. Торсионно-эффузионным методом в интервале 1406 – 1900К измерены давления двадцати двух расплавов системы Mn-Si. Для сплава эквимолярного состава при 1700К аMn = 0,0305; аSi = 0,1656. Изменения парциальных энергий Гиббса ∆GMn = -49321, ∆GSi = -25414 Дж/моль. При этом найдено, что ∆SMn = 5,021, ∆SSi = 9,895 кДж/(моль·К). Парциальные молярные энтальпии равны ∆НMn = -40786 и ∆НSi = -8594 Дж/(моль·К). Изменение интегральной энергии Гиббса ∆G1700К = -37367, ∆Н1700К = -24690 Дж/моль и ∆S = 7,64 Дж/(моль·К).
Система Mn-Р. По современным представлениям фосфор не образует твердых растворов в марганце, несмотря на сравнительно высокую растворимость в жидком марганце. В процессе кристаллизации расплавов системы образуются фосфиды. Известны фосфиды марганца Mn3Р, Mn2Р, Mn3Р2 и MnР (рисунок 2.4).
В расплавах системы Mn-Р имеет место сильное межчастичное взаимодействие марганца с фосфором, характеризующееся значительным отрицательным отклонениям от закона Рауля. Исследована активность фосфора в жидком марганце при 1593К. Понижение концентрации фосфора в марганце с 15 до 0,5% сопровождается уменьшением его активности с 0,041 до 3 · 10-5 при одновременном увеличении активности марганца с 0,59 до 0,98.
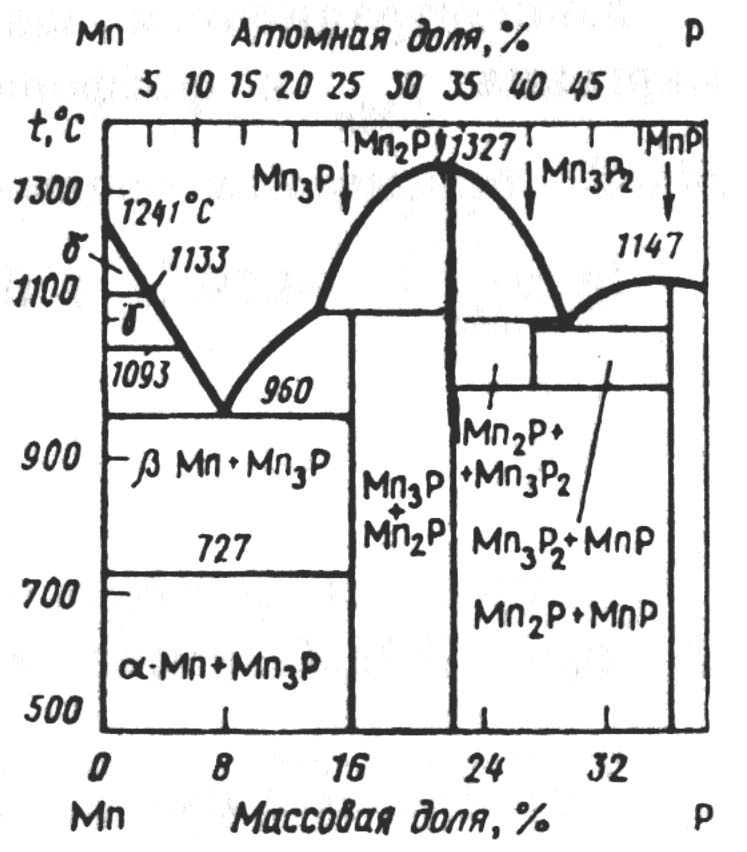
Рис. 2.4 − Диаграмма равновесного состояния системы Mn-Р
Концентрационная зависимость коэффициентов активности марганца γMn и фосфора γР при 1573К в сплавах системы Mn-Р описывается уравнениями:
lg γMn = -4,29/[1 + 0,455(хMn/хР)]2 (2.3)
lg γР = 18,88[1 + 0,455(хMnхР)]-1 - 1 + 0,455(хMn2/хР)]-1 (2.4)
Активность фосфора в жидком железе, содержащем 1-5% Р, при 1873К имеет положительное отклонение от закона Генри. Увеличение мольной доли фосфора до 0,1 повышает активность по кривой второго порядка до 0,5. Парциальная теплота растворения фосфора ∆HP в Fe составляет – 140, а в никеле – 251 кДж/моль. Изучение процессов испарения сплавов Mn-Р методом высокотемпературной масс-спектроскопии показало, что испарения фосфидов марганца Mn3Р и Mn2Р происходит конгруэнтно с последующей диссоциацией в газовой фазе на Mnг и Р2(г).
Система Mn-S. Марганец с серой образует термодинамически прочные сульфиды MnS и MnS2. Из представленной на рисунке 1.5 диаграммы состояния Mn-S следует, что моносульфид марганца Mn плавится при 1610°С. Изменение термодинамического потенциала реакции образования сульфида Mnт + 1/2Sт = MnSт в интервале 973-1573К описывается выражением ∆G°т = -296520 + 76,73Т, Дж/моль. Для реакции Mnт + 1/2О2 = MnО ∆G°т = -388860 + 76,21Т, Дж/моль. Стандартная энтальпия образования MnS2 ∆Н°298 К = -204,18 кДж/моль.
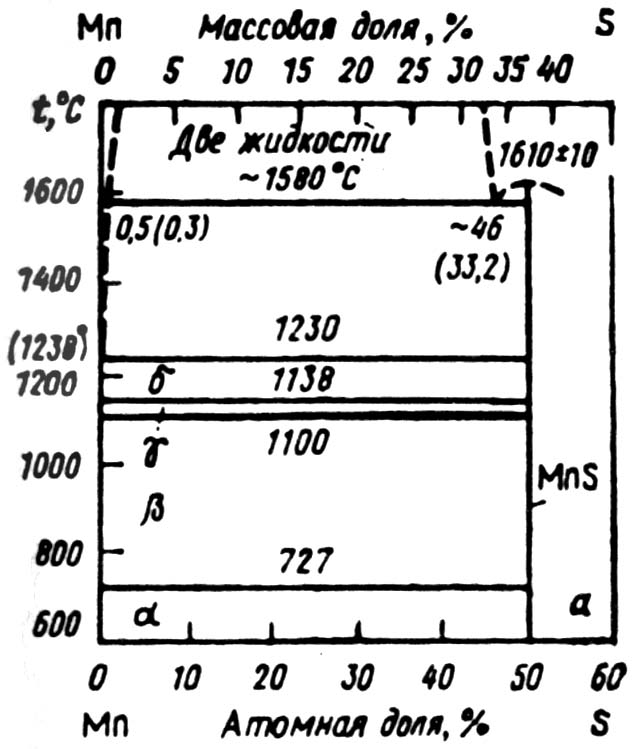
Рис. 2.5 − Диаграмма равновесного состояния системы Mn-S
Необходимость изучения свойств системы Mn-S и реакций восстановления оксидов и карбидов углеродом, кремнием с участием серы обусловлена положительным влиянием серы в определенных интервалах ее концентрации на физико-химические свойства шлаков (снижение вязкости и др.).
Система Mn-О. Диаграмма фазовых равновесий в системе Mn-О при парциальном давлении рО2= 20 кПа представлена на рисунке 2.6. Уравнение для расчета растворимости кислорода в жидком марганце при αMnО = 1 имеет вид:
lg[О]Mn = - 4823/Т + 1,159. (2.5)
Эвтектике при 1515К соответствует содержание кислорода 0,0095%, температура плавления MnО 2115К, хотя до предварительных ранее исследований считали ее равной 1823К.
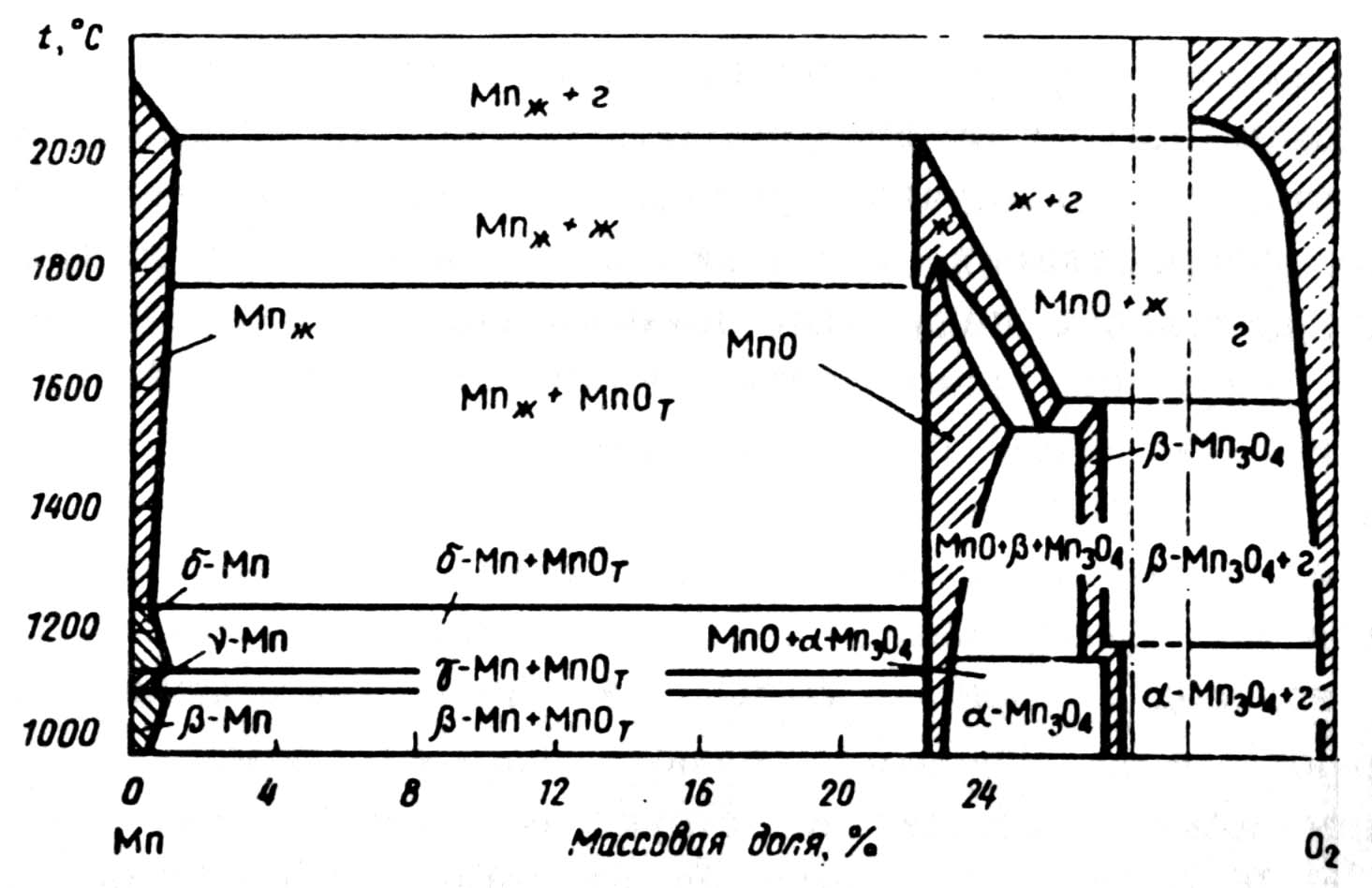
Рис. 2.6 − Диаграмма состояния системы Mn-О при рО2= 20 кПа
Экспериментально исследована система Mn-О при Т > 1273К в различных парциальных давлениях кислорода: от 50 до 21 кПа. Исследовано равновесие фаз для парциальных давлений кислорода 0,5; 30; 3000 и 2100 Па. Температуре 1273К независимо от величины рО2соответствует равновесная фаза α-Mn3О4. При рО2= 20 кПа исключается возможность образования равновесной фазы манганозита (MnО), а β-Mn3О4 при 1580°С переходит в расплав. Если же рО2понизить до 3 кПа, то β-Mn3О4 при 1450°С переходит в MnО, а превращение MnОт → расплав наступает при 1657°С. Для случая, когда рО2= 30 кПа, установлено, что стадия β-Mn3О4 → MnО имеет место при 1543-1623К, а MnОт → расплав при 2030К. При рО2= 0,5 Па фаза β-Mn3О4 вообще не обнаружена, превращение α-Mn3О4 в MnО зафиксировано при 1363-1373К, а переход MnОт → расплав при 2120К.
 2015-10-13
2015-10-13 2501
2501
