Ионный обмен можно рассматривать как гетерогенную химическую реакцию и представить в виде примера следующими уравнениями:
а) катионный обмен:
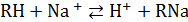 ; (20.56)
; (20.56)
б) анионный обмен:
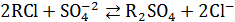 ; (20.57)
; (20.57)
Промежуточное положение между катионитами и анионитами занимают амфолиты, которые включают кислотные и основные ионогенные группы, выступая (в зависимости от условий проведения процесса) в роли катионита или анионита.
В соответствии со степенью ионизации в растворе катиониты делятся на сильнокислотные (КУ) и слабокислотные (КБ); аниониты подразделяют на высокоосновные (АВ) и низкоосновные (АН).
По степени пористости синтетические иониты можно подразделить на гелевые и макропористые. Макропористые иониты обладают гораздо более развитой пористой структурой, чем гелевые, что значительно ускоряет транспорт вещества внутри гранулы.
При контакте ионообменных смол с растворами электролитов подвижные противоионы замещаются на эквивалентное количество ионов раствора электролита, например по уравнениям (20.56) и (20.57). В зависимости от противоиона, которым насыщена ионо-обменная смола, различают Н-форму, Na-форму, Са-форму и т. п. для катионитов и соответственно ОН-форму, Cl- форму и т. п. для анионитов. Отметим, что активные группы находятся во всем
объеме ионитов. Трехмерная структура ионита представляет собой как бы губку, в порах которой при набухании находятся растворитель и противоионы. Для обмена ионы раствора должны продиффундировать в матрицу и обменяться с ее противоионами.
Кинетические свойства ионообменных смол и их обменная емкость зависят также от строения матрицы. В зависимости от сшивки углеводородных цепей меняется набухаемость ионита. Увеличивая степень сшивки, можно добиться такого размера элементарной ячейки матрицы, когда диффузия ионов внутрь ионита будет невозможна из-за их размеров. В этом случае ионный обмен возможен только на поверхности частицы ионита. Матрица ионита
вместе с фиксированными ионами в растворах представляет собой
твердый нерастворимый полином, заряд которого компенсируется
зарядами противоионов противоположного знака.
У катионитов фиксированные ионы заряжены отрицательно, у анионитов-положительно.
Сильнокислотные катиониты способны к обмену ионов в щелочной, нейтральной, кислой средах. В качестве фиксированных ионов сильнокислотные компоненты обычно содержат группу SO3.
Слабокислотные катиониты способны к обмену катионов только
при pH ≥ 7. В качестве фиксированных ионов они имеют различные слабодиссоциирующие группировки, например – СОО-.
Сильноосновные аниониты способны к обмену в широком диапазоне pH. Эти аниониты наиболее часто содержат в качестве фиксированных ионов группу N+.
Слабоосновные аниониты способны к обмену анионов только при pH < 7. К ним относятся аниониты с первичными, вторичными и третичными аминогруппами: - 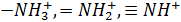 .
.
Некоторые иониты содержат одновременно сильно- и слабо- диссоциирующие активные группы.
Ионообменные смолы обладают большой емкостью, химической стойкостью и механической прочностью. Изменяя состав активных групп и матрицы, получили ионообменные смолы самых различных свойств.
Равновесие при ионном обмене. Сорбционную способность ионитов оценивают полной обменной емкостью, рабочей и равновесной обменной емкостью. Полная обменная емкость равняется общему числу ионогенных групп на единицу массы или объема ионита (экв/г или экв/см3) и представляет собой предельную сорбционную способность ионитов. Рабочая емкость не является чисто статической (равновесной) характеристикой ионита, так как представляет собой среднюю рабочую концентрацию сорбированного иона, отнесенную ко всему объему ионита в неподвижном слое при проведении
неравновесного сорбционного процесса. Рабочая концентрация зависит как от статических факторов, так и от скорости массопередачи.
Равновесная концентрация в ионите меньше полной обменной емкости, когда обратная реакция ионного обмена считается полностью подавленной. На равновесную концентрацию влияют все факторы, определяющие химическое равновесие реакции ионного обмена, включая величину pH и температуру.
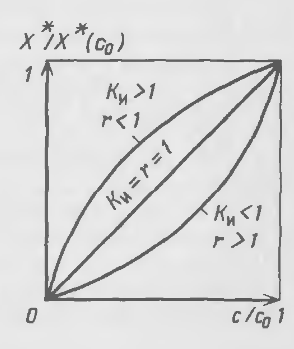
Равновесные концентрации контактирующих фаз в процессах ионного обмена, как и в случае адсорбции, связаны уравнением изотермы (рис. 20-12). Наиболее часто уравнение изотермы устанавливают на основе закона действующих масс. Взяв в качестве примера реакцию катионного обмена, записанную в общей форме:
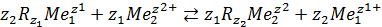 ,
,
получим уравнение изотермы
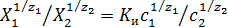 , (20.58)
, (20.58)
 Где
Где 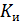 - константа равновесия;
- константа равновесия; 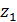 и
и 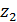 - стехиометрические коэффициенты; X1 и Х2 - концентрации катионов Me1 и Ме2 в ионите, кг/кг; c1 и c2 - концентрации
- стехиометрические коэффициенты; X1 и Х2 - концентрации катионов Me1 и Ме2 в ионите, кг/кг; c1 и c2 - концентрации
катионов Me1 и Ме2 в растворе, кг/м3.
Поскольку полученное уравнение содержит три независимые переменные, для получения уравнения изотермы вида 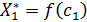 или
или 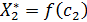 нужно
нужно
добавить два уравнения баланса вещества
X1 + X2 = X0 c1 + c2 = c0,
где Х0 - полная обменная емкость ионита, кг/кг;
c0 - суммарная концентрация катионов в растворе, кг/м3.
Рис. 20-12. Изотермы ионного обмена
Для случая обмена равнозарядных ионов уравнение изотермы принимает вид уравнения (20.44) при г = 1/Ки. Форма изотермы ионного обмена в соответствии с уравнением (20.44) определяется величиной константы равновесия.
Кинетика ионного обмена. Приведенный ранее анализ кинетики адсорбции в неподвижном слое сорбента применим и для ионного обмена. Как и в случае адсорбции, задача нахождения профиля концентраций в контактирующих фазах, длины слоя или времени процесса заключается в решении системы уравнений материального баланса (20.19), кинетики (20.20) и изотермы (20.56). В случае равнозарядных ионов решение задачи кинетики ионного обмена и ленгмюровской адсорбции в отсутствие продольного перемешивания представляется едиными уравнениями (20.46) и (20.47), различающимися лишь выражением фактора разделения r. В случае более сложных изотерм решение системы уравнений кинетики обычно находят численным методом с помощью ЭВМ.
Кинетика ионного обмена в неподвижном слое адсорбента, как и в случае адсорбции, может быть описана основным уравнением массопередачи (20.20). Отличительной особенностью кинетики ионного обмена является наличие стадии гетерогенной химической реакции, скорость которой обычно выше скорости диффузионных стадий процесса. Кроме того, следует учесть, что при ионном обмене скорость массопередачи часто лимитируется внутренним массопереносом.
В связи со сходством математического описания кинетики адсорбции и ионного обмена рассмотренные ранее основные методы расчета дсорбционных аппаратов применимы и для расчета ионообменной аппаратуры.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Назовите наиболее рациональные области применения адсорбции.
2. Дайте характеристику основных промышленных адсорбентов.
3. Раскройте сущность статической и динамической активности адсорбентов.
4. Что понимают под адсорбционным потенциалом?
5. Охарактеризуйте равновесие при адсорбции. Раскройте принцип построения изотерм адсорбции.
6. Как составляется материальный баланс адсорбции?
7. Раскройте особенности кинетики процесса равновесной адсорбции.
8. Покажите устройство и принцип действия адсорберов с неподвижным слоем адсорбента.
9. Покажите устройство и принцип действия адсорберов с псевдоожиженным и плотным движущимся слоями адсорбента.
10. Перечислите методы регенерации адсорбентов.
11. Раскройте принципы и назовите стадии расчета адсорберов.
12. Сформулируйте основы ионного обмена.
ГЛАВА 21
СУШКА
Сушкой называется процесс удаления влаги из веществ (обычно твердых тел) путем ее испарения и отвода образующихся паров. Часто тепловой сушке предшествуют механические способы удаления влаги (отстаивание, фильтрование, центрифугирование и др.).
Во всех случаях при сушке в виде пара удаляется легколетучий компонент (вода, органический растворитель и т. д.). Этот процесс применяется обычно или на конечной стадии технологического процесса с целью обеспечения высоких физико-механических характеристик получаемых продуктов, или на промежуточных стадиях, если удаление растворителя необходимо по технологическим соображениям.
По физической сущности сушка является процессом совместного тепломассопереноса и сводится к перераспределению и перемещению влаги под воздействием теплоты из глубины высушиваемого материала к его поверхности и последующему ее испарению. В процессе сушки влажное тело стремится к состоянию равновесия с окружающей парогазовой средой, поэтому его температура t l, и влагосодержание 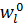 в общем случае являются функцией времени (τ) и координат (х, у, z):
в общем случае являются функцией времени (τ) и координат (х, у, z):
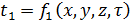 , (21.1)
, (21.1) 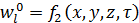 . (21.2)
. (21.2)
Под влагосодержанием w ° понимают отношение массы влаги W, содержащейся в теле, к массе абсолютно сухого тела Gc:
w °= W /Gс.
В практике используют и понятие влажности w (в связи с тем что обычно удаляется не вся влага):
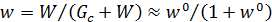 .
.
При малых значениях влагосодержания w °«1 величина 1 + w °≈1 и величины w и w ° практически не различаются. Зависимостью температуры влажного тела от времени можно пренебречь, если она становится равновесной много быстрее, чем влагосодержание.
Уравнения (21.1) и (21.2) описывают динамику нагрева и сушки тела. Их решения (в конкретных формах) даю т информацию о профилях температур и влагосодержания. Что касается кинетики процесса, то она характеризуется изменением средних по объему влагосодержаний 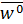 и температур
и температур 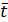 :
:
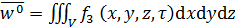 , (21.3)
, (21.3) 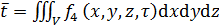 . (21.4)
. (21.4)
При этом под интенсивностью сушки понимают ее скорость —d 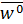 /dτ, которая по мере приближения к состоянию равновесия уменьшается (в дальнейшем знак минус перед производной —d
/dτ, которая по мере приближения к состоянию равновесия уменьшается (в дальнейшем знак минус перед производной —d 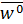 /dτ опускается). Скорость процесса является функцией ряда факторов, и в первую очередь внутренней структуры материала и его тепло-физических свойств, размеров, формы и состояния внешней поверхности.
/dτ опускается). Скорость процесса является функцией ряда факторов, и в первую очередь внутренней структуры материала и его тепло-физических свойств, размеров, формы и состояния внешней поверхности.
По способу подвода теплоты различают:
конвективную сушку, проводимую путем непосредственного контакта материала и сушильного агента. Подвод теплоты осуществляется газовой фазой (воздух или смесь воздуха с продуктами сгорания топлива), которая в процессе сушки охлаждается с увеличением своего влагосодержания;
контактную (кондуктивную) сушку, которая реализуется путем передачи теплоты от теплоносителя к материалу через разделяющую их стенку;
радиационную сушку - путем передачи теплоты инфракрасным излучением;
сублимационную сушку, при которой влага удаляется из материала в замороженном состоянии (обычно в вакууме);
диэлектрическую сушку, при которой материал высушивается в поле токов высокой частоты.
Следует отметить, что при любом способе организации процесса материал находится в контакте с влажным газом. Поэтому целесообразно рассмотреть физические свойства влажного газа. В большинстве случаев удалению из материала подлежит вода, поэтому обычно рассматривают систему сухой воздух-пары воды.
 2015-10-14
2015-10-14 3911
3911
