| Процесс | Работа W | Изменение внутренней энергии Δ U | Теплота Q |
| Изобарный | p (V 2- V 1) | nC VΔ T | nC р(T 2- T 1) |
| Изотермический | nRT ln(V 2/ V 1) | 0 | nRT ln(V 2/ V 1) |
| Изохорный | nC V(T 2- T 1) | nC V(T 2- T 1) | |
| Адиабатический | nC V(T 1- T 2) | nC V(T 2- T 1) | 0 |
| Изобарно-изотермический (химическая реакция) | ΔnRT | 0 | ΔnRT |
Для расчета теплоты используют понятие теплоемкости, которая определяется следующим образом: 
Если нагревание происходит при постоянном объеме или давлении, то теплоемкость обозначают соответствующим нижним индексом:  ;
; 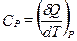 .
.
Теплоемкость – количество теплоты, которое необходимо сообщить 1 моль вещества, чтобы нагреть его на 1 К.
Для некоторых веществ теплоемкость можно также оценить теоретически методами статистической термодинамики. Так, при комнатной температуре для одноатомных идеальных газов мольная теплоемкость C V = 3/2 R, для двухатомных газов C V = 5/2 R (C р = 5/2 R – для одноатомных газов, C р = 7/2 R - для двухатомных газов.)
C p - C V = R
При обратимом адиабатическом расширении идеального газа давление и объем связаны соотношением (уравнением адиабаты): pV γ= const, где γ = C p / C V
TV γ -1 = const T γ p 1- γ = const.
 2015-10-22
2015-10-22 1315
1315








