Атом представляет собой сложную микросистему находящихся в движении элементарных частиц. Он состоит из положительно заряженного ядра и отрицательно заряженных электронов. Носителем положительного заряда ядра является протон. В ядра атомов всех элементов, за исключением ядра легкого изотопа водорода, входят протоны и нейтроны. Число протонов в ядре атома, а также число электронов определяются порядковым номером элемента. Число нейтронов находят по разности между молярной массой атома и порядковым номером элемента. Основные характеристики протонов, нейтронов и электронов приведены в табл. 1.
Таблица 1
Параметры некоторых элементарных частиц
| Частица | Символ | Масса покоя, кг | Заряд, Кл |
| Протон | p | 1,679·10-27 | 1,602·10-19 (+) |
| Нейтрон | n | 1,675·10-27 | |
| Электрон | ē | 9,108·10-31 | 1,602·10-19 (–) |
Современная теория строения атома основана на законах, описывающих движение микрочастиц (элементарных частиц). В 20-е годы ХХ века появился раздел физики, описывающий движение и взаимодействие микрочастиц, – квантовая механика.
Движение электрона в атоме под действием электростатического поля ядра описывается волновой функцией y (х, у, z) (пси-функцией). Она находится при решении уравнения Шредингера (1926 г.).
Из решения этого уравнения находят целочисленные параметры n, l и ml, получившие название квантовых чисел.
Квантовые числа определяют размер (n), форму (l) и ориентацию (ml) атомной орбитали (АО) в пространстве (рис. 1). Они связаны с физическими свойствами электрона. Число n (главное квантовое число) характеризует энергетический (квантовый) уровень электрона; число l (орбитальное) – момент количества движения (энергетический подуровень), число ml (магнитное) – магнитный момент.
Главное квантовое число n может принимать любые целые положительные значения от 1 до ¥.
Орбитальное квантовое число l связано со значением главного квантового числа n; оно изменяется в интервале 0…(n – 1). Когда n = 1, l = 0, при n = 2 значения l = 0 и l = 1 и т. д.
 |
Рис. 1. Формы s-, p- и d-электронных облаков (орбиталей)
Каждое значение орбитального квантового числа принято обозначать буквенными символами:
l 0 1 2 3 4...
символ s p d f g...
Значение магнитного квантового числа ml изменяется от –l до +l, а всего это число может принимать (2 l + 1) значений, включая нулевое.
Например: l = 1 ml = –1, 0, 1;
l = 2 ml = –2, –1, 0, 1, 2 и т. д.
Детальное изучение свойств атома водорода показало, что электрон имеет ещё собственный магнитный и механический моменты, которые объединили общим названием “спин” и ввели в связи с этим четвёртое квантовое число, принимающее всего два значения +1/2 и –1/2, которое назвали
ms – спиновое число.
 Атомная орбиталь (АО) – геометрический образ одноэлектронной волновой функции, зависящей от квантовых чисел n, l и ml, представляющий собой область наиболее вероятного пребывания электрона в атоме.
Атомная орбиталь (АО) – геометрический образ одноэлектронной волновой функции, зависящей от квантовых чисел n, l и ml, представляющий собой область наиболее вероятного пребывания электрона в атоме.
Для условного изображения АО принят символ квадрата, называемый квантовой или электронной ячейкой. Так как каждой АО отвечает только одно значение ml, то число АО, или квантовых ячеек, для данной величины орбитального квантового числа l будет следующим:
 | |||||
 |  | ||||
n s – АО n p – АО n d – АО
ml = 0 ml = –1 0 1 ml = –2 –1 0 1 2
 |
n f– АО
ml = –3 –2 –1 0 1 2 3
 Согласно принципу Паули в атоме не может быть двух электронов, характеризующихся одинаковым набором квантовых чисел. Из этого следует, что каждая АО может быть занята не более чем двумя электронами, причем их спиновые квантовые числа должны быть различными, что графически обозначают.
Согласно принципу Паули в атоме не может быть двух электронов, характеризующихся одинаковым набором квантовых чисел. Из этого следует, что каждая АО может быть занята не более чем двумя электронами, причем их спиновые квантовые числа должны быть различными, что графически обозначают.
Порядок расположения АО по возрастанию их энергий следующий:
1s< 2s< 2p< 3s< 3p< 4s£ 3d< 4p<5s£ 4d< 5p< 6s< 4f< 5d< 6p...
Порядок заполнения электронами АО определяется правилом Клечковского: АО заполняются электронами в порядке последовательного увеличения суммы n + l, а при одинаковых значениях этой суммы – в порядке последовательного возрастания главного квантового числа n.
Размещение электронов по АО в пределах одного энергетического под-уровня определяется правилом Хунда, согласно которому минимальной энергии атома соответствует такое распределение электронов по АО данного подуровня, при котором абсолютное значение суммарного спина атома максимально.
Элементы периодической системы имеют две основные характеристики: атомную массу и порядковый номер. Порядковый номер элемента равен заряду ядер атомов данного элемента. Это важнейшая характеристика, определяющая электронную структуру атомов и химические свойства элемента.
Современная формулировка периодического закона: свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атома или порядкового номера элемента.
Периодическая система поделена на периоды и группы.
Периодом называют горизонтальную последовательность элементов, начинающуюся со щелочного металла и заканчивающуюся элементом VIII А группы (инертным газом) с тем же значением главного квантового числа, совпадающего с номером периода.
Группой называют вертикальную совокупность элементов, обладающих однотипной электронной конфигурацией. Номер группы соответствует числу внешних валентных электронов.
В короткопериодной форме периодической системы восемь групп, каждая из которых делится на две подгруппы – главную (А), начинающуюся элементами второго периода, и побочную (В), начинающуюся элементами четвертого периода.
Электронными аналогами называют элементы, у которых валентные электроны расположены на орбиталях, описываемых общей для данных элементов формулой. В периодической системе элементов электронные аналоги входят в состав одной подгруппы.
Кроме этого, все элементы периодической системы объединяются в семейства s-, p-, d-, f-элементов.
Распределение электронов в атоме по энергетическим уровням, подуровням, АО отображают с помощью электронных формул (конфигураций). Электронная формула обозначается группой символов nlx, где n – главное квантовое число; l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение – s, p, d, f); x – число электронов данного подуровня (АО).
По характеру распределения электронной плотности в молекуле химические связи подразделяют на ковалентные, ионные, металлические.
1.Ковалентная связь – химическая связь между двумя атомами, осуществляемая общей для этих атомов парой электронов.
Различают два механизма образования ковалентной связи: обменный и донорно-акцепторный.
При обменном механизме ковалентная связь образуется двумя электронами, обладающими противоположно направленными спинами и принадлежащими разным атомам.
Донорно-акцепторный механизм образования ковалентной связи осуществляется в том случае, когда один из атомов (донор) предоставляет для связи пару электронов, а другой (акцептор) – вакантную орбиталь. Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, называются комплексными.
Комплексные соединения состоят из внутренней (координационной) и внешней сфер. Внутренняя сфера получила название комплекса. Например, в комплексном соединении [ Cu (NH 3)4] SO 4
внутренняя сфера – [ Cu (NH 3)4]2+; внешняя сфера – SO 42 –.
Комплексы бывают:
– катионные [Cu(NH3)4]2+;
– анионные [Fe(CN)6]3–;
– нейтральные [Ni(CO)4].
Комплекс имеет центральный атом- комплексообразователь, чаще всего это катион d -элемента, имеющий вакантные орбитали. В указанных примерах это Cu2+, Fe3+, Ni0.
Вокруг комплексообразователя координируются молекулы или ионы, их называют лигандами. Лигандами могут быть молекулы H2O, NH3, CO, CH3NH2, ионы CN–, OH–, NO2–, Cl–, Br–, I– и другие, имеющие неподеленные пары электронов. В приведенных примерах это NH3, CN–, CO.
Заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов.
Координационное число – это общее число лигандов, входящих во внутреннюю сферу комплексного соединения. В приведенных примерах это 4, 6, 4. Координационное число часто в два раза превышает валентность комплексообразователя, но не всегда. Например, Fe 2+ имеет комплексное число 6, а Au3+ – 4.
Диссоциация комплексных соединений в растворах происходит по типу сильных электролитов (первичная диссоциация):
K3[Fe(CN)6] «3K+ + [Fe(CN)6]3–.
Комплекс диссоциирует лишь частично, по типу слабого электролита (вторичная диссоциация):
[Fe(CN)6]3– «Fe3+ + 6CN–
Устойчивость комплексных соединений характеризуется константой нестойкости (Kнест), чем она меньше, тем прочнее комплекс:
Kнест[Fe(CN)6]3–  = 10–44.
= 10–44.
Название комплексного соединения, как и любого другого сложного вещества, читается справа налево, т. е. вначале называется электроотрицательная составляющая формулы в именительном падеже, а затем – электроположительная в родительном падеже.
Названия лигандов в комплексных соединениях:
| H 2 O | – | аква | CO | – | карбонил | OH– | – | гидроксо |
| NH 3 | – | аммин | CN– | – | циано | Cl – | – | хлоро |
Названия чисел:
| – | моно | – | три | – | пента | |||
| – | ди | – | тетра | – | гекса |
Например:
| [ Ag (NН 3)2] Cl | – | хлорид диамминсеребра; |
| [ Cr (H 2 O)5 Cl ] C 2 | хлорид хлоропентааквахрома (III); | |
| Na 3[ Al (OH)6] | – | гексагидроксоалюминат натрия; |
| K [ BF 4 ] | – | тетрафтороборат калия. |
Для оценки способности атома данного элемента оттягивать к себе электроны, осуществляющие связь, пользуются значением относительной электроотрицательности (ЭО). При взаимодействии элементов, имеющих одинаковые значения ЭО, образуется неполярная ковалентная связь. При образовании ковалентной связи между атомами разных элементов электронное облако смещается к атому с большим значением ЭО и возникает ковалентная полярная связь. Чем больше разность электроотрицательностей, тем больше полярность связи.
Для предсказания геометрической структуры молекул используют идею гибридизации атомных орбиталей центрального атома.
2. Ионная связь – результат электростатического взаимодействия противоположно заряженных ионов, обладающих обособленными друг от друга электронными оболочками. Эту связь можно рассматривать как предельный случай полярности химической ковалентной связи, которому отвечает значительное смещение пары электронов связи к наиболее электроотрицательному атому. Чем это смещение больше, тем ближе связь к чисто ионной.
3. Металлическая связь реализуется в кристаллической решетке металла, в узлах которой расположены ионы металла, а валентные электроны относительно свободно перемещаются по всему объему кристалла, обеспечивая связь между ионами, но, не выходя за пределы кристаллической решетки.
4. Водородная связь возникает в тех случаях, когда атом водорода, связанный с атомами сильно электроотрицательного элемента, способен к образованию еще одной химической связи. Наличие водородных связей приводит к заметной полимеризации воды, фтороводорода, многих органических соединений.
В веществах с молекулярной структурой проявляется межмолекулярное взаимодействие. Силы межмолекулярного взаимодействия, называемые также силами Ван-дер-Ваальса, слабее сил, приводящих к образованию ковалентной связи, но проявляются они на больших расстояниях. Основную роль в их образовании играет взаимодействие молекулярных диполей.
Пример 1. Напишите электронную формулу атома P, иона P3−.
Исходя из электронной формулы элемента, определите наиболее устойчивые степени окисления, приведите формулы оксидов, которые данный элемент может образовать. Укажите характер оксидов и возможные гидратные соединения, которые могут быть образованы при взаимодействии оксидов с водой. Укажите, какие элементы являются электронными аналогами данного элемента, запишите их общую электронную формулу.
Решение. Атом фосфора находится в третьем периоде и VА группе периодической системы Д. И. Менделеева, т. е. относится к семейству р - элементов. Порядковый номер элемента 15, следовательно, атом фосфора содержит
15 электронов. Распределяем эти электроны по АО: 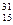 Р 1s22s22p63s23p3.
Р 1s22s22p63s23p3.

 5 внешних электронов атома фосфора распределяются по правилу Гунда следующим образом:
5 внешних электронов атома фосфора распределяются по правилу Гунда следующим образом:
Ион P3− образуется при условии, что атом фосфора принимает 3 электрона. Соответственно, внешний электронный уровень атома примет вид
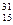 Р3− … 3s23p6
Р3− … 3s23p6
 |  |
В соответствии со строением внешнего электронного слоя атома фосфора данный элемент может отдать 5 электронов, и при этом он приобретает степень окисления Р5+ (высшая положительная), а может отдать 3 р-электрона, тогда степень окисления будет равна Р3+ (промежуточная положительная). Если он принимает на внешний уровень 3 электрона до образования устойчивой 8-электронной оболочки, то степень окисления станет равна Р3−.
Фосфор легко окисляется кислородом. При этом, учитывая указанные степени окисления, образуются оксиды Р2О5 и Р2О3.
Оксиды фосфора проявляют свойства кислотных оксидов. При взаимодействии с водой оксида Р2О5 образуются метафосфорная НРО3 либо ортофосфорная Н3РО4 кислота. Гидратными формами оксида Р2О3 являются метафосфористая НРО2 либо ортофосфористая Н3РО3 кислота.
Электронными аналогами фосфора являются элементы, находящиеся с ним в одной подгруппе: азот, мышьяк, сурьма, висмут. Общая электронная формула для этих элементов имеет вид ns2 np3.
Пример 2. Для атома кремния, имеющего молярную массу атома МА
28 г/моль и порядковый номер 14: 1) указать состав атомного ядра, число электронов; 2) составить электронную формулу атома в стационарном состоянии и возможных возбужденных состояниях.
Решение. 1. В состав атомных ядер входят положительно заряженные протоны (p), число которых определяется порядковым номером элемента, и нейтроны (n), число которых можно узнать по разности между молярной массой атома и его порядковым номером. Число электронов (ē) в атоме равно числу протонов в ядре. Итак, для атома кремния p = 14; n = 28-14=14; ē = 14.
2. Составляем электронную формулу атома кремния. Порядковый номер элемента равен 14, следовательно, он содержит 14 электронов. Соответственно, формула 1s2 2s2 2p6 3s2 3p2. Валентными являются орбитали третьего электронного слоя, т. е. 3s, 3p и свободные 3d-орбитали. Графически схема заполнения имеет вид



3s 3p 3d
Размещение электронов на 3p подуровне показано здесь в соответствии с правилом Гунда, суммарный спин атома имеет при этом максимальное значение (1). Атом кремния в невозбужденном состоянии имеет 2 неспаренных электрона.
При затрате энергии один из 3s электронов атома кремния может быть переведён на вакантную 3p орбиталь; при этом энергия атома возрастает, так что возникает электронная конфигурация 1s2 2s2 2p6 3s1 3p3, которая соответствует одному из возможных возбужденных состояний кремния



3s 3p 3d
В этом состоянии у атома кремния 4 неспаренных электрона.
Пример 3. Охарактеризовать состояние каждого электрона с помощью набора квантовых чисел (n, l, ml, s) для электронного фрагмента 2s22p3.
Решение. Данному электронному фрагменту будет соответствовать следующий набор квантовых чисел:
| Номер электрона | |||||
| n | |||||
| l | |||||
| ml | –1 | ||||
| ms | +1/2 | –1/2 | +1/2 | +1/2 | +1/2 |
Главное квантовое число n равно двум, т. к. электроны атома расположены на втором уровне. Для двух электронов, расположенных на s-подуровне орбитальное квантовое число равно l = 0, для трех, расположенных на р–подуровне, l = 1.
Магнитное квантовое число изменяется от - l до + l, следовательно, для электронной орбитали s-подуровня ml = 0, а для трех орбиталей р-подуровня может принимать значения –1, 0, +1. В соответствии с принципом Паули два электрона, расположенные на s-орбитали, имеют спиновые квантовые числа, отличающиеся знаками (± ½), а р-подуровень занимают, согласно правилу Гунда, три неспаренных электрона, поэтому их спиновые квантовые числа одинаковы и равны +1/2.
Пример 4. Составьте формулы молекул и комплексных соединений из следующих частиц: OH−, Cu2+, SO42+, Ca2+, NH3 - и укажите тип химической связи в них.
Решение. 1. Из указанных частиц можно составить формулы двух соединений: гидроксида кальция Ca(OH)2 и сульфата тетраамминмеди(II) [Cu(NH3)4]SO4.
Сульфат тетраамминмеди(II) относится к комплексным соединениям, в которых между атомом-комплексообразователем (медью) и лигандами (молекулами аммиака) образуется ковалентная связь по донорно-акцепторному механизму. В гидроксиде кальция связь между Ca2+ и OH− ионная.
№ 101–125. Напишите электронную формулу нейтрального атома и атома в определенной степени окисления. Исходя из электронной формулы элемента, определите наиболее устойчивые степени окисления, приведите формулы оксидов, которые данный элемент может образовать. Укажите характер оксидов и возможные гидратные соединения, которые могут быть образованы при взаимодействии оксидов с водой. Укажите, какие элементы являются электронными аналогами данного элемента, запишите их общую электронную формулу.
| Вариант | Атом, ион | Вариант | Атом, ион | Вариант | Атом, ион |
| Cl, Cl– | P, P5+ | S, S 2– | |||
| Ca, Ca2+ | Ti, Ti4+ | V, V2+ | |||
| Co, Co2+ | As, As3– | Se, Se4+ | |||
| Mn, Mn7+ | Fe, Fe3+ | Si, Si4– | |||
| Br, Br3+ | Cu, Cu+ | Ni, Ni2+ | |||
| Ge, Ge4– | Cr, Cr2+ | As, As3+ | |||
| Zn, Zn2+ | Cl, Cl7+ | S, S4+ | |||
| Y, Y+ | Sn, Sn2+ | Ge, Ge4+ | |||
| S, S6+ |
№ 126–150. Для атома с молярной массой МА и порядковым номером Z:
1) укажите состав атомного ядра, число электронов; 2) составьте электронную формулу атома в стационарном состоянии и возможных возбужденных состояниях.
| № | Z | МА | № | Z | МА | № | Z | МА |
№ 151–175. Приведите полную электронную формулу и укажите все возможные возбужденные состояния атома, внешний квантовый слой которого имеет вид вариантов в таблице. На основе электронной формулы сделайте вывод о валентностях атома, как в основном, так и возбужденном состоянии.
| № | Внешний квантовый слой | № | Внешний квантовый слой | № | Внешний квантовый слой |
| 3s23p5 | 6s25d2 | 2s12p2 | |||
| 3s23p3 | 6s24f1 | 2s22p3 | |||
| 3s23p4 | 6s24f3 | 4s23d1 | |||
| 4s13d5 | 6s25d3 | 3s13p3 | |||
| 4s23d5 | 5s24d1 | 4s23d1 | |||
| 4s23d3 | 5s25p2 | 3d54p1 | |||
| 4s24p3 | 5s25p3 | 5s14d4 | |||
| 4s24p4 | 6s26p1 | ||||
| 5s24d3 | 6s26p2 |
№ 176–200. Составьте формулы молекул и комплексных соединений из частиц, приведенных в таблице, назовите их и укажите тип химической связи в них. Напишите уравнения процесса диссоциации комплексных соединений и запишите в общем виде выражения для констант нестойкости комплексных ионов.
| № | Частицы | № | Частицы |
| Cl−, Mn2+, H2O, K+, CN− | Ni3+, CO, ClO3−, Na+, OH− | ||
| Al3+, OH−,, Ca2+, SO42−, NH3 | Ba2+, Zn2+, H2O, S2−, OH− | ||
| Co2+, CN−, K+, S2-, NO | Mg2+, Ag+, CN−, Na+ OH− | ||
| Na+, Fe3+, Cl−, CO, CO32− | K+, Al3+, NH3, OH−, Cl− | ||
| K+, Fe2+, F−, Ca2+, H2O | I−, Ca2+,, Cu2+, CN−, SO42− | ||
| Ba2+, Zn2+, Cl−, OH−, NH3 | K+, I−, NH3, Co2+, NO3− | ||
| Li+, Br−, Ag+, CO, NO2− | Cr3+, Mg2+, CO, Cl−, SO42− | ||
| K+, Ti2+, F-, H+, NO3− | Cd2+, NH3, Cl−, ClO−, Ca2+ | ||
| Rb+, NO, F−, Cr3+, NO2− | Zr4+, F−, NH4+, Ba2+, SO32− | ||
| H+, Cu2+, SiO32-, Cl−, K+ | Pt4+, Cl−, Ca2+, H+, S2− | ||
| B3+, K+, CO32-, Br-, H+ | Cr2+, H2O, Cl−, PO43−, Na+ | ||
| Li+, Fe3+, F−, SO42−, CO | K+, Be2+, OH−, Mg2+, I− | ||
| Hg2+, I−, K+, Ca2+, SO42− |
№ 201–225. Дайте названия комплексных соединений, указанных в табл., напишите уравнения процесса их диссоциации и запишите в общем виде выражения для констант нестойкости комплексных ионов.
| № | Комплексное соединение | № | Комплексное соединение |
| (NH4)2[TiF6] | [Ni(NH3)6]Cl2 | ||
| [Cu(NH3)4] Cl2 | [Co(NH3)4(NO2)2]Cl | ||
| K2[HgBr4] | [Pt(NH3)4 ]F2 | ||
| K4[Fe(CN)6] | K2[Co(SCN)4] | ||
| Na[AgI2] | Na3[IrCl6] | ||
| [Cr(H2O)6](OH)3 | [Zn(NH3)4]SO4 | ||
| H[AuCl4] | Cu2[Fe(CN)6] | ||
| [Ag(NH3)2]Cl | [Ti(H2O)6](OH)4 | ||
| K2[PtCl6] | [W(H2O)5(OH)](OH)2 | ||
| [Cr(H2O)5OH](OH)2 | [Ni(NH3)6](NO2)2 | ||
| [Fe(CO)4]I2 | K2[Cd(OH)4] | ||
| [Cu(NH3)4(H2O)2]SO4 | Na[Ag(CN)2] | ||
| Na[Au(OH)4] |
3. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
Раздел химии, изучающий превращения различных видов энергии друг в друга, называется термодинамикой. Термодинамика устанавливает законы этих превращений, а также направление самопроизвольного течения различных процессов в данных условиях.
Раздел термодинамики, изучающий тепловые эффекты химических реакций, называется термохимией. Реакции, которые сопровождаются выделением теплоты, называются экзотермическими, а те, в которых тепло поглощается, эндотермическими.
Величину H называют энтальпией системы. Теплота реакции равна изменению энтальпии системы. Энтальпия является функцией состояния системы, ее изменение (D H) определяется только конечным (H2) и начальным (Н1) состоянием системы: D H = H 2 – H 1.
При экзотермических реакциях энтальпия системы уменьшается и
D H < 0, а при эндотермических энтальпия системы увеличивается и D H > 0.
Термохимические расчеты основаны на законе Гесса (1840 г.): тепловой эффект реакции зависит только от начального и конечного состояния участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
Из закона Гесса следует, что термохимические уравнения можно складывать, вычитать и умножать на численные множители.
Часто в термохимических расчетах применяют следствие из закона Гесса: тепловой эффект реакции (D Н х.р) равен сумме теплот образования (D H обр.) продуктов реакции за вычетом суммы теплот образования исходных веществ:
 .
.
Энтропия – S, так же как внутренняя энергия U и энтальпия H, является функцией состояния системы. Энтропия отражает движение частиц вещества, является мерой неупорядоченности системы и мерой количества вещества. Она возрастает с увеличением скорости движения частиц – при нагревании, испарении, плавлении, расширении газов, при ослаблении или разрыве связей между атомами и т. п. Процессы, связанные с упорядоченностью системы: конденсация, кристаллизация, сжатие, полимеризация и т. п. – ведут к уменьшению энтропии.
Изменение энтропии (D S) зависит только от начального (S1) и конечного (S2) состояния системы и не зависит от пути процесса.
D S 0х.р = å S 0прод – å S 0исх
D S = S 2 – S 1 если S 2 > S 1, то D S > 0;
если S 2 < S 1, то D S < 0.
Энтропия выражается в Дж/моль×K.
Движущая сила химического процесса складывается из двух составляющих: стремление к упорядочению (–D H) и стремление к беспорядку (+D S). При p = const и T = const общую движущую силу процесса (D G) можно найти из соотношения
D G= D H – T D S.
Величина G называется изобарно-изотермическим потенциалом, или энергией Гиббса.
Энергия Гиббса химической реакции характеризует направление и предел самопроизвольного протекания реакции в условиях постоянства температуры и давления. Энергия Гиббса является функцией состояния системы, пoэтому  .
.
Самопроизвольно протекающие процессы идут в сторону уменьшения D G. Если D G < 0, процесс принципиально осуществим, если D G > 0, процесс самопроизвольно проходить не может. Чем меньше D G, тем сильнее стремление к протеканию данного процесса и тем дальше он от состояния равновесия, при котором D G = 0 и, следовательно, ΔH = T·ΔS.
Пример 1. Исходя из теплоты образования газообразного диоксида углерода (D H = –393,5 кДж/ моль) и термохимического уравнения
С (графит) + 2N2О (г) = CO2 (г) + 2 N2 (г); D H0 = –557,5 кДж, (1)
вычислите теплоту образования N2O (г).
Решение. Обозначив искомую величину через х, запишем термохимическое уравнение образования N2O из простых веществ:
N2 (г) + 1/2 О2 (г) = N2O (г); D H10 = х кДж. (2)
Запишем также термохимическое уравнение реакции образования СО2 (г) из простых веществ:
С (графит) + О2 (г) = CO2 (г); D H20 = –393,5 кДж. (3)
Из уравнений (2) и (3) можно получить уравнение (1). Для этого умножим уравнение (2) на два и вычтем найденное уравнение из (3).
Имеем С(графит) + 2N2O (г) = СО2 (г) + 2N2 (г); (4)
DH0 = (–393,5 – 2х) кДж.
Сравнивая уравнения (1) и (4), находим
–393,5 – 2 х = –557,5, откуда х = 82,0 кДж/ моль.
Пример 2. Пользуясь данными табл. 2 приложения, вычислите D H0 реакции: 2Mg (к) + СО2 (г) = 2MgO (к) + С(графит).
Решение. По данным табл. 2 стандартные энтальпии образования СО2 и MgO равны соответственно –393,5 и –601,8 кДж/моль (напомним, что стандартные энтальпии образования простых веществ равны нулю). Отсюда для стандартной энтальпии реакции находим
 = –601,8×2 + 393,5 = –810,1 кДж.
= –601,8×2 + 393,5 = –810,1 кДж.
Пример 3. По величине изменения энергии Гиббса определите, возможна ли следующая реакция:
SiO2 (к) + 2NaOH (р) = Na2SiO3 (к) + H2O (ж),
D G0SiO2(к) = –803,75 кДж/моль; D G0 Na2SiO3(к) = –1427,8 кДж/моль;
D G0NaOH (р) = –419,5 кДж/моль; D G0 H2O(ж) = –237,5 кДж/моль?
Можно ли выпаривать щелочь в стеклянном сосуде?
Решение. Изменение энергии Гиббса D G 0298 реакции равно:
D G 0298 = åD G 0прод. реак – åD G 0исход. вещ.
D G 0298 = (–1427,8 – 237,5) – (–803, 75 – 419,5 – 2) = –22,55 кДж;
D G 0298 =–22,55 кДж (т. е. D G 0 < 0), а следовательно, данная реакция возможна. Щелочь нельзя выпаривать в стеклянном сосуде, так как в состав стекла входит SiO2.
Пример 4. Вычислите стандартное изменение энергии Гиббса химического процесса при 25 0С: NH3 (г) + HСl (г) = NH4C l (к), если значение DH0298 и S0298 реагирующих веществ следующие:
| Вещество | NH3 | HСl | NH4Cl |
| DH0298, кДж/моль | –46,19 | –92,30 | –315,39 |
| S0298, Дж/(моль×К) | 192,50 | 186,70 | 94,56 |
Решение. Определяем DH0298 реакции:
DH0298 =  – (
– ( +
+  ) = –315,39 – (–46,19 – 92, 30) =
) = –315,39 – (–46,19 – 92, 30) =
= –176,9 кДж/моль
Изменение энтропии реакции:
DS0298 =  – (
– ( +
+  ) = 94,56 – (192,50 + 186,70) =
) = 94,56 – (192,50 + 186,70) =
= –284,64 Дж/(моль×К). 
Используя уравнение Гиббса – Гельмгольца, находим изменение энергии Гиббса:
DG0 = DH0 – T×DS = –176,9 + 284,64×10-3×298 = –176,9 + 84,8 = –92,1 кДж/моль.
Так как DG0 < 0, данная реакция термодинамически возможна (протекает самопроизвольно) и является экзотермической (DH< 0).
Пример 5. Реакция восстановления Fe2O3 водородом протекает по уравнению Fe2O3(k) + 3H2(г) = 2Fe(k) + 3H2O(г); DH = 96,6 кДж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии ×D S = 0,1387кДж/(моль·град)? При какой температуре начнется восстановление Fe2O3?
Решение. Вычислим ΔG реакции:
ΔG = ΔH – TΔS = 96,6 – 298·0,1387 = 55,28 кДж.
Так как ΔG >0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет окисление железа (коррозия). Найдем температуру, при которой ΔG = 0: ΔH = TΔS;  .
.
Следовательно, при температуре 696,5 К начнется реакция восстановления Fe2O3 водородом. Иногда эту температуру называют температурой начала реакции.
№ 226–235. По заданным термохимическим уравнениям рассчитайте стандартную энтальпию образования веществ, указанных в таблице. Для решения задачи используйте данные из табл. 2 приложения.
| № | Термохимические уравнения | Вещество | |
| 4NO2(г) + O2(г) + H2O(ж) = 4HNO3(ж) | ΔH0298= –256 кДж | HNO3 | |
| 2CuO(к) + 4NO2(г) + O2(г) = 2Cu(NO3)2(к) | ΔH0298= –440 кДж | Cu(NO3)2 | |
| 2Mg(NO3)2(к) = 2MgO(к) +4NO2(г) + O2(г) | ΔH0298= +510 кДж | Mg(NO3)2 | |
| 2SO2(г) + O2(г) + H2O(ж) = 2H2SO4(ж) | ΔH0298 = –462 кДж | H2SO4 | |
| 4Na2SO3(к) = 3Na2SO4(к) + Na2S(к) | ΔH0298 = –176 кДж | Na2SO3 | |
| 2Al2O3(к) + 3О2(г) + 6SO2(г) = 2Al2(SO4)3(к) | ΔH0298=-1750 кДж | Al2(SO4)3 | |
| 2Na2HPO4(к) = Na4P2O7(к) + H2O(ж) | ΔH0298 = +58 кДж | Na2HPO4 | |
| 2(NH4)2CrO4(к)= Cr2O3(к) + N2(г) + 5H2O(ж) + + 2NH3(г) | ΔH0298 = –89 кДж | (NH4)2CrO4 | |
| 4KСlO4(к) = 2KСlO3(к) + 2KCl(к) + O2(г) | ΔH0298 = +60 кДж | KСlO4 | |
| Na2CO3(к)·10H2O(к) = NaOH(к) + СО2(г) + + 9H2O(г) | ΔH0298 = +662 кДж | Na2CO3(к)·10H2O |
№236–245. Определите тепловые эффекты реакций, указанных в таблице. Значения энтальпий образования веществ возьмите в табл. 2 приложения.
| № | Уравнения реакций |
| a) Fe2O3(к) + 3H2(г) = 2Fe(к) + 3H2O(г) b) Fe2O3(к) + 3C(к) = 2Fe(к) + 3CO(г) | |
| a) MgO(к) + CO2(к) = MgCO3(к) b) Mg(OH)2(к) + CO2(г) = MgCO3(к) + H2O(ж) | |
| a) C6H12O6(к) = 2C2H5OH(ж) + 2CO2(г) b) C6H12O6(к) + 6O2(г) = 6H2O(ж) + 6CO2(г) | |
| a) 3Fe3O4(к) + 8Al(к) = 9Fe(к) + 4Al2O3(к) b) Fe2O3(к) + 2Al(к) = 2Fe(к) + Al2O3(к) | |
| a) ZnS(к) + 3O2(г) = 2ZnO(к) + 2SO2(г) b) ZnSO4(к) = ZnO(к) + 2SO3(г) | |
| a) SO2(г) + 2H2S(г) = 3S(к) + 2H2O(ж) b) 2SO2(г) + O2(г) = 2SO3(г) | |
| a) CaC2(к) + 2 H2O(ж) = Ca(OH)2(к) + C2H2(г) b) 2KClO3(к) = 2KCl(к) + 3O2(г) | |
| a) 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж) b) NH3(г) + HCl(г) = NH4Cl(к) | |
| a) Na2CO3(к) + SiO2(к) = Na2SiO3(к) + CO2(г) b) Na2O(к) + SiO2(к) = Na2SiO3(к) | |
| a) KNO3(к) + H2SO4(ж) = KHSO4(к) + HNO3(ж) b) 2KNO3(к) + H2SO4(ж) = 2HNO3(ж) + K2SO4(к) |
№ 246-255. Рассчитайте тепловой эффект химической реакции, при условии, что в реакцию вступает либо в ходе реакции образуется 1 кг вещества. Необходимые для расчета величины возьмите в табл. 2 приложения.
| № | Уравнение реакции | Вещество |
| 2KNO3(к) + H2SO4(ж) = 2HNO3(ж) + K2SO4(к) | KNO3 | |
| Na2CO3(к) + SiO2(к) = Na2SiO3(к) + CO2(г) | SiO2 | |
| Fe2O3(к) + 2Al(к) = 2Fe(к) + Al2O3(к) | Al | |
| 2Na(к) + 2H2O(ж) = 2NaOH(ж) + H2(г) | NaOH | |
| ZnS(к) + 3O2(г) = 2ZnO(к) + 2SO2(г) | ZnS | |
| SO2(г) + 2H2S(г) = 3S(к) + 2H2O(ж) | S | |
| C6H12O6(к) + 6O2(г) = 6H2O(ж) + 6CO2(г) | C6H12O6 | |
| 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(г) | NH3 | |
| Mg(OH)2(к) + CO2(г) = MgCO3(к) + H2O(ж) | MgCO3 | |
| Fe2O3(к) + 3C(к) = 2Fe(к) + 3CO(г) | Fe2O3 |
№ 256–265. Запишите термохимические уравнения взаимодействия веществ А и В с образованием вещества С. Рассчитайте стандартную энтальпию образования С, если известна масса вещества А и тепловой эффект реакции ΔН (кДж). Необходимые для расчета величины возьмите в табл. 2 приложения.
| А | m(A), г | B | C | ΔН, кДж. | |
| Fe(к) | 2,1 | S(к) | FeS(к) | -3,77 | |
| CuO(к) | 12,7 | C(к) | CO(г) | +8,24 | |
| S(к) | H2(г) | H2S(г) | -10,45 | ||
| S(к) | O2(г) | SO3(г) | -197,6 | ||
| Zn(к) | O2(г) | ZnO(к) | -5,32 | ||
| Cl2(г) | H2(г) | HCl(г) | -2,6 | ||
| Na(к) | H2O(ж) | NaOH(ж) | -40,25 | ||
| Na2O(к) | H2O(ж) | NaOH(ж) | -36,6 | ||
| CaC2(к) | H2O(ж) | Ca(OH)2(к) | -31,3 | ||
| Fe2O3(к) | Al(к) | Al2O3(к) | -426,5 |
№ 266–275. Рассчитайте тепловой эффект реакции при условии, что в реакцию вступает или в ходе реакции образуется газ (А), объем которого составляет V, л. Необходимые для расчета величины возьмите в табл. 2 приложения.
| № | Уравнение реакции | А | V, л |
| H2(г) + O2(г) = 2H2O(г) | H2 + O2 | 8,4 | |
| CaC2(к) + 2H2O(ж) = Ca(OH)2(к) +C2H2(г) | C2H2 | ||
| 2Na(к) + 2H2O(ж) = 2NaOH(к) + H2(г) | H2 | 22,4 | |
| C2H2(г) + 2,5O2(г) = 2CO2(г) + H2(г) | O2 | 44,8 | |
| 2KClO3(к) = 2KCl(к) + 3O2(г) | O2 | 2,24 | |
| 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж) | NH3 | ||
| H2(г) + CO(г) + O2(г) = CO2(г) + H2O(г) | CO + H2 | ||
| SO2(г) + 2H2S(г) = 3S(к) + 2H2O(ж) | H2S | ||
| Fe2O3(к) + 3CO(г) = 2Fe(к) + 3CO2(г) | CO | ||
| C6H12O6(к) + 6O2(г) = 6H2O(ж) + 6CO2(г) | O2 | 11,2 |
№ 276–285. Вычислите изменение энергии Гиббса и сделайте вывод, какая из двух реакций более вероятна при стандартных условиях. Необходимые для расчета величины возьмите в табл. 2 приложения.
| № | Уравнения реакций |
| a) SO2(г) + 2H2S(г) = 3S(к) + 2H2O(ж) b) 2SO2(г) + O2(г) = 2SO3(г) | |
| a) 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж) b) NH3(г) + HCl(г) = NH4Cl(к) | |
| a) 2Na(к) + 2H2O(ж) = 2NaOH(к) + H2(г) b) Na2O(к) + H2O(ж) = 2NaOH(ж) | |
| a) KNO3(к) + H2SO4(ж) = KHSO4(к) + HNO3(ж) b) 2KNO3(к) + H2SO4(ж) = K2SO4(к) + 2HNO3(ж) | |
| a) Na2CO3(к) + SiO2(к) = Na2SiO3(к) + CO2(г) b) Na2O(к) + SiO2(к) = Na2SiO3(к) | |
| a) Fe2O3(к) + 3H2(г) = 2Fe(к) +3H2O(г) b) Fe2O3(к) + 3C(тв) = 2Fe(к) + 3CO(г) | |
| a) MgO(к) + CO2(г) = MgCO3(к) b) Mg(OH)2(к) + CO2(г) = MgCO3(к) + H2O(ж) | |
| a) C6H12O6(к) = 2C2H5OH(ж) + 2CO2(г) b) C6H12O6(к) +6O2(г) = 6H2O(ж) + 6CO2(г) | |
| a) 3Fe3O4(к) + 8Al(к) = 9Fe(к) + 4Al2O3(к) b) Fe2O3(к) + 2Al(к) = 2Fe(к) + Al2O3(к) | |
| a) 2ZnS(к) + 3O2(г) = 2ZnO(к) + 2SO2(г) b) ZnSO4(к) = ZnO(к) +SO3(г) |
№ 286–295. Определите, при какой температуре, 0 ºС, 25 ºС или 1000 ºС, более вероятно протекание реакции, указанной в таблице. Необходимые для расчета величины возьмите в табл. 2 приложения.
| Уравнение реакции | |
| 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж) | |
| SO2(г) + 2H2S(г) = 3S(к) + 2H2O(ж) | |
| 2Na(к) + 2H2O(ж) = 2NaOH(к) + H2(г) | |
| Na2CO3(к) + SiO2(к) = Na2SiO3(к) + CO2(г) | |
| 2KNO3(к) + H2SO4(ж) = K2SO4(к) + 2HNO3(ж) | |
| Fe2O3(к) + 3CO(г) = 2Fe(к) + 3CO2(г) | |
| Mg(OH)2(к) + CO2(г) = MgCO3(к) + H2O(ж) | |
| C6H12O6(к) +6O2(г) = 6H2O(ж) + 6CO2(г) | |
| Fe2O3(к) + 2Al(к) = 2Fe(к) + Al2O3(к) | |
| 2ZnS(к) + 3O2(г) = 2ZnO(к) + 2SO2(г) |
№ 296–305. Определите температуру, при которой для реакций, указанных в таблице, наступит состояние равновесия. Сделайте вывод о направлении реакции выше и ниже этой температуры. Необходимые для расчета величины возьмите в табл. 2 приложения.
 2015-10-22
2015-10-22 1840
1840