Для каждой однородной системы справедливо соответствующее уравнение состояния, которое связывает между собой ее объем, давление и температуру. Для идеальных газов, для которых расстояние между образующими их частицами (молекулы, атомы) гораздо больше размеров самих частиц и можно пренебречь взаимодействием между ними в виду его малости, такое уравнение имеет вид

Это уравнение называется уравнение Менделеева – Клапейрона. Отметим, что Р – давление, создаваемое газом или суммарное давление всех компонентов газовой смеси, V – объем, Т - температура по шкале Кельвина
(0°С=273 К) и R – универсальная газовая постоянная, равная в Международной системе единиц 8,31 Дж/(моль×К).
Ели давление измеряется в Па, то объем – в м3, или, соответственно, давление в кПа, а объем – в л.
1 л = 10–3 м3; 1 кПа = 103 Па.
Задание. Газ массой 30,3 г заполнил сосуд вместимостью 15 л при температуре 180С. Давление газа внутри сосуда составляет 12200 Па. Рассчитайте молярную массу газа.
М = 
5. Закон эквивалентов. Эквивалентом элемента называют такое его количество, которое соединяется с одним моль атомов водорода или замещает то же количество атомов водорода в химических соединениях.
Э(элемента) =  , моль-экв. (Валентность – это число химических связей, образуемых данным атомом).
, моль-экв. (Валентность – это число химических связей, образуемых данным атомом).
Всегда Э(Н) = 1 моль-экв, Э(О) = ½ моль-экв.
Масса одного эквивалента элемента называется его эквивалентной массой.
МЭ (элемента) = М(элемента)×Э(элемента), г/моль-экв.
Всегда МЭ(Н) = 1 г/моль-экв, МЭ(О) = 8 г/моль-экв,
Задание. Определить эквивалент и эквивалентную массу азота в NH3 и углерода в метане CH4.
Э(N) = 1/3 моль-экв, МЭ (N) = 14/3 = 4,67 г/моль-экв;
Э (С) = 1/4 моль-экв, МЭ (С) = 12/4 = 3 г/моль-экв.
Задание. Определите эквивалентную массу азота в оксиде N2O.
МЭ (N) = 14/1 = 14 г/моль-экв
Эквивалент оксида равен:
Э(оксида) =  .
.
МЭ (оксида) = М(оксида)×Э(оксида).
Задание. Определить эквивалентную массу оксида азота NО2.
МЭ (NО2)=  г/моль-экв.
г/моль-экв.
Эквивалент кислоты равен:
Э (кислоты)= 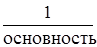 . Основность – это число атомов водорода в молекуле кислоты.
. Основность – это число атомов водорода в молекуле кислоты.
МЭ (кислоты) = М(кислоты)×Э(кислоты).
Задание. Определить эквивалентную массу угольной кислоты Н2СО3.
МЭ (Н2СО3)=  г/моль-экв.
г/моль-экв.
Эквивалент основания равен:
Э(основания) =  . Кислотность – это число гидроксогрупп в молекуле основания.
. Кислотность – это число гидроксогрупп в молекуле основания.
МЭ (основания) = М(основания)×Э(основания).
Задание. Определить эквивалентную массу гидроксида алюминия Al(OH)3.
МЭ (Al(OH)3)=  г/моль-экв.
г/моль-экв.
Эквивалент соли равен:
Э(соли) =  .
.
МЭ (соли) = М(соли)×Э(соли).
Задание. Определить эквивалентную массу сульфата железа (III) Fe2(SO4)3.
МЭ (Fe2(SO4)3)=  г/моль-экв.
г/моль-экв.
Рихтер сформулировал закон: Массы веществ, которые вступают в реакцию и образуются в результате реакции, пропорциональны их эквивалентам или эквивалентным массам.
 или
или  .
.
Задание. При соединении 1,50 г натрия с хлором образовалось 3,81 г хлорида натрия. Найти эквивалентную массу натрия, если эквивалентная масса хлора 35,45 г/моль-экв.
m(Cl) = m(NaCl) – m(Na) = 3,81 – 1,50 = 2,31 г.
 ,
,  ,
,  г/моль-экв.
г/моль-экв.
Задание. Рассчитайте эквивалентную массу и валентность железа, если 22,4 г железа соединяются с 9,6 г кислорода.
 ;
;  , МЭ(О) = 16/2=8 г/моль-экв.
, МЭ(О) = 16/2=8 г/моль-экв.
 г/моль-экв.
г/моль-экв.
МЭ (Fe) = М (Fe)×Э(Fe), Э(Fe) = 1/валентность, МЭ (Fe) =  ,
,
Валентность = 56/18,67 = 3.
 2015-10-22
2015-10-22 1305
1305








