Лекция №
ТЕМА: Свойства газов. Модель идеального газа. Давление газа.
Температура и ее измерение.
План
1 Идеальный газ. Давление газа.
2. Среднеквадратичная скорость движения молекул.
3. Основные уравнения МКТ идеального газа.
4. Температура и тепловое равновесие.
5. Абсолютная температура. Термодинамическая шкала температур.
6. Зависимость давления газа от температуры. Связь между абсолютной температурой газа и средней кинетической энергией.
1. Идеальный газ – модель, соответственно которой:
1. размерами молекул газа пренебрегают сравнительно с расстоянием между ними;
2. между молекулами нет сил взаимодействия;
3. столкновения молекул газа между собой и со стенками сосуда абсолютно упруги.
Давление газа - удары молекул о стенки сосуда.
2. Сталкиваясь со стенкой, молекулы оказывают на нее давление – р0 (среднее). Чтобы найти р0 , нужно знать значение среднеквадратичной скорости молекул –  2.
2.
Средняя: 1) потому, что молекул очень много;
2) скорость одной молекулы может быть как очень большой, так и очень
малой.
3). Квадрат, так как от этой величины зависит Ек энергия молекул:

Но квадрат модуля какого-либо вектора равен сумме квадратов его проекций на оси координат Ох; Оу; Оz. Поэтому
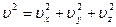
Связь между  – средним значением и средним значением квадратов проекции такое:
– средним значением и средним значением квадратов проекции такое: 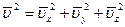
Так как направления Ох; Оу; Оz вследствие беспорядочного движения молекул равноправные, то  , тогда средний квадрат проекции скорости равен:
, тогда средний квадрат проекции скорости равен:

Вывод. Скорость молекул все время изменяется, но средний квадрат скорости вполне определенная величина.
Задание. Найдите среднее значение длины пальцев.
3. Основные уравнения МКТ идеального газа – устанавливает связь между давлением газа от средней кинетической энергии его молекул.

Найдем давление газа на стенку СД сосуда
АВСД, пл. S
Каждая молекула передает стенке импульс
 , отталкиваясь
, отталкиваясь  .
.
Всего за t: общий импульс равен: 2 
Так как молекул много, то за 1 с они передают импульс: 2  z Z – Количество столкновений
z Z – Количество столкновений
n – Концентрация молекул.
Z ~n
n =  ; Z ~
; Z ~  ; Z ~ S, то есть Z ~ n
; Z ~ S, то есть Z ~ n  S
S
Так как только одна часть движется к стенке, а другая от нее; то
Z = 
Полный импульс составляет:
2  z = 2 ·
z = 2 · 
 n
n  S =
S =  n S
n S
Согласно с II законом Ньютона изменение импульсу какого-либо тела за единицу времени равно действующей на него силе:
F=  n S
n S
Так как 
 F =
F = 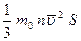
 Давление газа: p =
Давление газа: p = 
p =  (1)- основное уравнение МКТ.
(1)- основное уравнение МКТ.

 Связь давления p с Еср к: Е =
Связь давления p с Еср к: Е =  , то (1) имеет вид p=
, то (1) имеет вид p=  .
.
Давление идеального газа пропорционально произведению концентрации молекул на средне кинетическую энергию поступательного движения молекул.
Так как произведение  равно массе молекул в единице объема, то есть плотности вещества: p =
равно массе молекул в единице объема, то есть плотности вещества: p =  , тогда
, тогда
 p =
p =  ρ
ρ 

 , ρ=
, ρ=  - плотность вещества.
- плотность вещества.
[ p ] = 
4. Главное место в изучении тепловых явлений занимает определение температуры. Температура характеризует степень нагретости тела (холодное, теплое, горячее). Для ее измерения используют измерительный прибор – термометр. В его строении используется свойство тела изменять объем во время нагрева или охлаждения.
Почему нужно несколько минут, чтобы термометр показал температуру?
Тепловым равновесием – называют такое состояние, при котором все макроскопические параметры (Т, V, р) очень долго остаются неизменными, то есть между телами системы не происходит теплообмен.
Опыт 1. Стакан с водой и льдом, закрытый.
Температура характеризует состояние теплового равновесия системы тел: все тела системы находятся друг с другом в тепловом равновесии, имеют одинаковую температуру.
Температура – физический параметр, одинаковый во всех частях системы тел, которая пребывает в состоянии теплового равновесия.
Температура какого-либо тела тесно связана с энергией хаотичного движения его молекул, то есть внутренней энергией тел.
Внутренняя энергия – это сумма Ек энергии движения всех его молекул и Ер энергии их взаимодействия.
5. Для измерения температуры возможно использовать изменение какого-либо макроскопического параметра - Т, V, р.
В обычном термометре используют зависимость объема жидкости от температуры. За 0 принята температура таяния льда, 100 – tкипения воды. Расстояние разбито на 100 маленьких штришков. 1 деление – называется градус Цельсия.
Но так как какие-либо жидкости расширяются во время нагрева неодинаково, то шкала будет зависеть от свойств этой жидкости.
Чтобы не учитывать эту зависимость используют разреженные газы – водород, гелий, кислород. Т.к. во время нагрева они одинаково изменяют свое давление при изменении температуры. Поэтому используют шкалы, где может изменяться давление при V = const или изменение объема при р = const. Такую шкалу называют идеальной газовой шкалой.
Рассмотрим газы в состоянии теплового равновесия.
Опыт с Н2, О2 , Не.
Опыт показывает, что соотношение  – при тепловом равновесии остается одинаковым для всех газов и зависит только от Т.
– при тепловом равновесии остается одинаковым для всех газов и зависит только от Т.
Обозначим это значение через 
 = 3,76 · 10-21 Дж
= 3,76 · 10-21 Дж
при 100˚ С:  Дж
Дж
Значение  не зависит от V, р, N газа, а только от Т. Поэтому температуру можно измерять в Дж.
не зависит от V, р, N газа, а только от Т. Поэтому температуру можно измерять в Дж.
Чтобы перейти к ˚ С, пользуются соотношением:
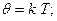 k – Коэффициент пропорциональности, Т- абсолютная температура
k – Коэффициент пропорциональности, Т- абсолютная температура
 или
или  k = 1,38 10 -23 Дж/К; постоянная Больцмана
k = 1,38 10 -23 Дж/К; постоянная Больцмана
Постоянная Больцмана связывает температуру в энергетических единицах с температурой в кельвинах.
Абсолютный нуль температур – температура, при которой должно полностью прекратиться поступательное движение молекул.
Т = 0 К; t = - 273˚С
Шкала Кельвина – термодинамическая шкала температур, начало – температура абсолютного нуля. Связь между абсолютной температурой и температурой по стоградусной шкале такая: T = 273 + t. [T] = K
 Температура – является мерой средней кинетической энергии молекул. Средняя кинетическая энергия хаотичного поступательного движения молекул прямо пропорциональна абсолютной температуре
Температура – является мерой средней кинетической энергии молекул. Средняя кинетическая энергия хаотичного поступательного движения молекул прямо пропорциональна абсолютной температуре

Зависимость давления газа от концентрации его молекул и температуры: р = nkT;
 n – Концентрация молекул
n – Концентрация молекул
Зная температуру, можно посчитать среднюю кинетическую энергию (что уже сделано), и среднюю скорость молекул по формуле:





Скорость молекул больше скорости звука. Эти скорости удалось измерить благодаря опыту Штерна
Нормальные атмосферные условия:
р0 = 1,013· 105 Па Т0 = 273 К
Вопросы для самоконтроля:
1 Что понимают под моделью идеального газа?
2. Чем образуется давление газа? Основное уравнение МКТ.
3. Что понимают под тепловым равновесием? Приведите примеры?
4. Что понимают под внутренней энергией?
5. От чего зависит внутренняя энергия?
6. Почему не всегда для измерения температуры возможно использовать
жидкости?
7. Можно ли измерять температуру у Дж?
8. Как перейти от температуры в кельвинах к температуре в градусах
Цельсия?
9. Какая связь между кинетической энергией движения молекул и
температурой?
10. Как рассчитать среднеквадратичную скорость движения молекул?
Литература
1. Дмитрієва В.Ф. Фізика: Навч. посіб..- К.: Техніка, 2008.-648 с.: іл..(§40 -§45)
2. Владкова Р.А., Добронравов В.Є., Збірник задач і питань з фізики: Навч. посіб.- М.: Наука, 1988.-384 с.
 2015-10-22
2015-10-22 4427
4427