В зависимости от механизма превращения компонентов реакционной смеси, химические реакции разделяют на простые или элементарные реакции, протекающие в одну стадию и сложные, многостадийные химические реакции, состоящие из совокупности элементарных стадий.
В зависимости от количества фаз, содержащих компоненты реакционной смеси, различают гомофазные и гетерофазные химические реакции. Гомофазными являются реакции, все компоненты которых находятся в одной фазе; гетерофазными называют реакции, компоненты которых находятся в разных фазах.
В зависимости от зоны протекания химические реакции подразделяют на гомогенные и гетерогенные реакции. Зоной протекания гомогенной реакции является объем одной из фаз; зоной протекания гетерогенной реакции является поверхность контакта фаз.
Интенсивность протекания химической реакции характеризуется скоростью превращения компонентов реакционной смеси –  .
.
Скорость превращения 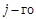 компонента
компонента  определяется изменением этого компонента в единице пространства зоны протекания реакции в единицу времени:
определяется изменением этого компонента в единице пространства зоны протекания реакции в единицу времени:
при протекании гомогенной реакции
 ,
,
где  – количество вещества [моль] ([кмоль]);
– количество вещества [моль] ([кмоль]);  – объем реакционной смеси [м3];
– объем реакционной смеси [м3];
при протекании гетерогенной реакции
 ,
,
где  – поверхность контакта фаз [м2].
– поверхность контакта фаз [м2].
Выразим количество вещества через его концентрацию в реакционной смеси:
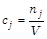 [моль/м3],
[моль/м3], 
тогда
 ;
;
аналогично этому, для гетерогенной реакции
 .
.
При условии, что реакция протекает без изменения объема,  и, следовательно,
и, следовательно,  , полученные выражения упрощаются:
, полученные выражения упрощаются:
скорость превращения гомогенной реакции
 ;
;
скорость превращения гомогенной реакции
 ,
,
где  – удельная поверхность контакта фаз.
– удельная поверхность контакта фаз.
Для элементарных реакций, протекающих в одну стадию, скорость превращения 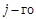 компонента определяется как произведение скорости стадии
компонента определяется как произведение скорости стадии  на соответствующий стехиометрический коэффициент
на соответствующий стехиометрический коэффициент  :
:
 ;
;
для сложных реакций скорость превращения 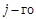 компонента определяется как совокупность, т. е. алгебраическая сумма, скоростей превращения
компонента определяется как совокупность, т. е. алгебраическая сумма, скоростей превращения 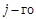 компонента по каждой стадии, в которой он участвует и как реагент и (или) как продукт реакции:
компонента по каждой стадии, в которой он участвует и как реагент и (или) как продукт реакции:
 ,
,
 – количество элементарных стадий, в которых участвует
– количество элементарных стадий, в которых участвует  компонент.
компонент.
При расчете скорости превращения компонента надо иметь в виду, что скорость стадии  берется со знаком «–», если компонент участвует в этой стадии как реагент и со знаком «+», если компонент является в этой стадии продуктом реакции.
берется со знаком «–», если компонент участвует в этой стадии как реагент и со знаком «+», если компонент является в этой стадии продуктом реакции.
Скорость каждой элементарной стадии определяется в соответствии с законом действующих масс: скорость реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам
 ,
,
где  – коэффициент пропорциональности, называемый константой скорости реакции.
– коэффициент пропорциональности, называемый константой скорости реакции.
Общий вид математической модели химической кинетики для гомогенной реакции, протекающей при постоянной температуре и без изменения объема реакционной смеси имеет вид:
 .
.
Пример.
Постановка задачи: разработать математическую модель кинетики гомогенной химической реакции, протекающей по механизму 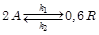 . Реакция протекает при постоянном объеме
. Реакция протекает при постоянном объеме  и постоянной температуре
и постоянной температуре  Константы скоростей стадий известны.
Константы скоростей стадий известны.
Запишем уравнения изменения концентраций компонентов реакционной смеси в соответствии с общим видом модели химической кинетики:

Определим скорости каждой стадии:

Найдем скорости превращений компонентов смеси:

После подстановки, окончательно математическая модель примет вид:
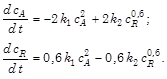
Практически все химические реакции сопровождаются выделением тепла (экзотермическая реакция) или поглощением тепла (эндотермическая реакция), что приводит к изменению температуры реакционной смеси, если процесс не термостатирован.
Изменение температуры реакционной смеси, прежде всего, повлияет на значение констант скоростей стадий, которые в данном случае уже не будут постоянными величинами, как в случае моделирования изотермической реакции, а также на физические свойства реакционной смеси: теплоемкость  и плотность
и плотность  .
.
При моделировании неизотермической химической реакции необходимо принять следующие упрощающие допущения:
1. Теплообмен с окружающей средой отсутствует, т.е. температура реакционной смеси изменяется только за счет тепловых эффектов химического взаимодействия;
2. Изменением теплофизических свойств реакционной смеси можно пренебречь  ;
;
3. Тепловой эффект реакции не зависит от изменения температуры реакционной смеси.
Таким образом, математическая модель неизотермической химической реакции должна включать следующие уравнения:
1. Температурные зависимости констант скоростей стадий, которые определяются по известному уравнению Аррениуса:
 ,
,
где  – температура реакционной смеси, [град К];
– температура реакционной смеси, [град К];
2. Систему дифференциальных уравнений изменения концентраций компонентов реакционной смеси  ;
;
3. Уравнение, определяющее скорость изменения температуры реакционной смеси:
 ,
,
где  – тепловой эффект реакции, отнесенный к единице какого-либо компонента смеси, условно обозначенного буквой К, [Кдж/кмоль К];
– тепловой эффект реакции, отнесенный к единице какого-либо компонента смеси, условно обозначенного буквой К, [Кдж/кмоль К]; 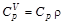 – объемная теплоемкость реакционной смеси, [Кдж/м3 град К];
– объемная теплоемкость реакционной смеси, [Кдж/м3 град К];  – скорость превращения того компонента смеси, к единице которого отнесен тепловой эффект реакции.
– скорость превращения того компонента смеси, к единице которого отнесен тепловой эффект реакции.
Тепловой эффект реакции берется со знаком «+», если реакция экзотермическая и со знаком «–», если реакция эндотермическая.
В качестве примера рассмотрим предыдущую реакцию, изменив постановку задачи.
Постановка задачи: разработать математическую модель кинетики гомогенной экзотермической химической реакции, протекающей по механизму 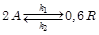 .
.
Тепловой эффект реакции отнесен к одному кмоль компонента 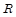 –
–  [Кдж/кмоль
[Кдж/кмоль 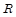 ]. Реакция протекает при постоянном объеме
]. Реакция протекает при постоянном объеме  .
.
Построение модели
Запишем уравнения констант скоростей стадий реакции:

Система дифференциальных уравнений изменения концентраций компонентов (из предыдущей задачи) имеет вид:

В соответствии с постановкой задачи, уравнение изменения температуры реакционной смеси примет вид:
 ,
,
или после соответствующей подстановки:

 2015-10-22
2015-10-22 929
929








