| Основные | Амфотерные | Кислотные |
Реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания. 1. Взаимодействие с водой (оксиды щелочных и щелочноземельных металлов) 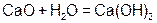 2. С кислотами 2. С кислотами 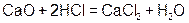 3. С кислотными оксидами 3. С кислотными оксидами 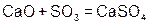 4. С амфотерными оксидами 4. С амфотерными оксидами 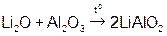 | Проявляют свойства основных и кислотных оксидов 1. Взаимодействуют как с кислотами, так и с основаниями 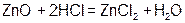 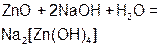 2. Реагируют с основными и кислотными оксидами 2. Реагируют с основными и кислотными оксидами 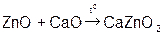 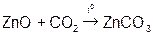 | Реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1. Большинство взаимодействуют с водой (искл. 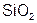 ) ) 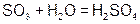 2. Со щелочами 2. Со щелочами 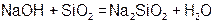 3. С основными оксидами 3. С основными оксидами 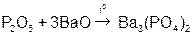 4. С амфотерными оксидами 4. С амфотерными оксидами 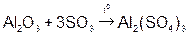 |
Гидроксиды – продукты прямого или косвенного взаимодействия оксидов с водой. Общая формула гидроксидов: ЭхОY · nH2O. По химическим свойствам различают кислотные, основные и амфотерные (Ме(ОН)n) гидроксиды, соответствующие кислотным, основным и амфотерным оксидам.
Кислотные гидроксиды (кислоты) –сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков. Общая формула Hn(ЭхОy), где n – основность кислоты. Получение и свойства (табл. 2, 3).
Таблица 2
Получение кислот
| Кислородсодержащие | 1. Кислотный оксид+вода | 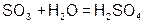 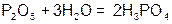 |
| 2. Неметалл+сильный окислитель | 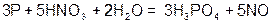 | |
| 3. Cоль+менее летучая кислота | 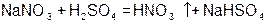 | |
| Бескислородные | 1. Водород+неметалл | 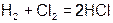 |
| 2. Cоль+менее летучая кислота | 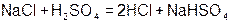 |
Таблица 3
 2015-10-22
2015-10-22 1047
1047








