Задание 1. Охарактеризуйте свойства представленных элементов, исходя из положения в периодической системе по плану согласно своему варианту (табл. 30).
Таблица 30
Исходные данные
| Вариант | Задание 1 (порядковый номер элемента) | Задание 2 | Вариант | Задание 1 (порядковый номер элемента) | Задание 2 |
| 1,16 | 14, 11 | ||||
| 2, 20 | 15, 28 | ||||
| 3, 18 | 16, 6 | ||||
| 4, 19 | 17, 7 | ||||
| 5, 17 | 18, 8 | ||||
| 6, 23 | 19, 29 | ||||
| 7, 24 | 20, 10 | ||||
| 8, 15 | 21, 30 | ||||
| 9, 27 | 22, 2 | ||||
| 10, 21 | 23, 3 | ||||
| 11, 22 | 24, 4 | ||||
| 12, 25 | 25, 5 | ||||
| 13, 26 | 29, 9 | ||||
| 27, 13 | 28, 1 | ||||
| 30, 14 | 26, 12 |
Задание 2
1. У атомов, какого из элементов – хрома (Сг) или селена (Sе) в большей степени выражены металлические свойства? При взаимодействии атомов хрома и селена какой из них проявляет восстановительные свойства?
2. Назовите элементы, отрицательные ионы которых имеют следующие электронные конфигурации: 1S22S22р6 (Э1–), 1S22S22p6 (Э2–); 1S22S22р63S23р6 (Э3–); [Аг] 3d104S24p6 (Э3–)?
3. Почему кислород и сера, имея в наружном слое одинаковое число электронов, проявляют разную валентность?
4. Может ли азот быть окислителем по отношению к хлору? Почему?
5. Напишите электронные конфигурации ионов Ba2+ и Lа3+. Почему атомы элементов бария и лантана являются сильными восстановителями?
6. Напишите краткую электронную конфигурацию атомов кремния (Si) и свинца (Pb). Являются ли они аналогами электронной структуры и, какие свойства проявляют?
7. Напишите электронные конфигурации ионов Se2- и Sе6+.. Почему для селена характерны как окислительные, так и восстановительные свойства?
8. Какой из атомов – хлор или йод – является окислителем при образовании молекулы IСl из атомов? У какого из этих атомов, сильнее выражена способность притягивать к себе электроны?
9. На основании электронного строения атома брома (Вг) определите число электронов, которые могут принимать участие в процессе окисления и восстановления этого атома. Приведите примеры атомов элементов VА-подгруппы окислителей и восстановителей по отношению к брому.
10. Запишите электронную конфигурацию двухзарядного отрицательного иона селена (Se2–). Изменяется ли радиус отрицательного иона селена по сравнению с нейтральным атомом селена и как?
11. Запишите электронную конфигурацию двухзарядного положительного иона марганца (Мп2+) и четырехзарядного (Мп4+). Как соотносятся энергии ионизации у этих ионов и их ионные радиусы?
12. Увеличиваются или уменьшаются значения энергии сродства к электрону у атомов элементов VIIА-подгруппы от фтора к астату?
13. Укажите номер подгруппы атомов элементов, у которых электронная конфигурация внешнего уровня и незавершенного предвнешнего подуровня (n – 1)d10 nS2.
14. Перечислите элементы, атомы которых завершают формирование К- и L-оболочек. К какой подгруппе и почему относятся эти элементы?
15. Назовите элемент, атомы которого на энергетическом уровне с
n = 5 имеют девять электронов. Перечислите аналоги электронной структуры этого элемента.
16. Объясните, какая из двух электронных конфигураций атома бора (В): первая – 1S22S12р2или вторая – 1S22S12р2соответствует основному состоянию? Покажите графически распределение электронов по атомным орбиталям.
17. Каким элементом s, р, d или f является лантан (Lа)? Ответ объясните.
18. Назовите номер периода ПСЭ, в котором располагаются элементы с 4d-формирующими электронами. Каково общее число 4d-элементов?
19. Запишите электронную конфигурацию атомов элементов № 24 и № 34. Почему они расположены в одном периоде (каком?) и одной группе (какой?)?
20. Почему в VII группе ПСЭ объединены атомы элементов неметаллов – галогенов (А-подгруппа) и атомы элементов с характерными металлическими свойствами (В-подгруппа)?
21. У атомов элементов IВ-подгруппы (Си, Аg, Аu) наблюдается явление «провала» электрона. Запишите общую сокращенную электронную формулу атомов этих элементов без «провала» и с «провалом» электрона; чем обусловлен этот эффект?
22. Что понимают под процессом ионизации данного атома? Затрачивается или поглощается энергия при образовании положительных ионов? Приведите примеры.
23. Почему атомы типичных металлов (приведите примеры) обладают малыми значениями первой энергии ионизации?
24. Назовите элементы, положительные ионы которых имеют следующие электронные конфигурации: 1S0 (Э2+); 1S22S0 (Э2+), 1S22S02p0 (Э3+); 1S22S22p0 (Э2+); 1S22S22p6 (Э4+).
25. Атомы, какого из элементов VIIА-подгруппы в большей степени проявляют восстановительные свойства по отношению к фтору?
Ответ поясните.
26. Магний или алюминий является более сильным восстановителем? Соответствует ли это большему значению первой энергии ионизации магния (7,6 Эв) по сравнению с алюминием (6,0 эв).
27. Объясните, у какого элемента – Ва или Са сильнее выражены металлические свойства. Какой характер оксидов?
28. Объясните, у какого элемента – Cr или Se сильнее выражены металлические свойства. Какой характер у оксидов и гидроксидов в зависимости от степени окисления этих элементов?
29. Расположите элементы в порядке возрастания их неметаллических свойств: олово, кислород, сера, теллур, селен. Ответ поясните.
30. Расположите оксиды в порядке возрастания их кислотных свойств: MgO, Al2O3, N2O5, B2O3, CO2. Ответ поясните.
Тестовые задания
1. В периодах ПСЭ Д.И. Менделеева с увеличением заряда ядра атома окислительные свойства элементов
а) усиливаются
б) ослабевают
в) остаются без изменений
г) сначала усиливаются, потом ослабевают
2. Энергия ионизации это –
а) способность атомов к присоединению или отдаче электронов
б) количество энергии необходимое для отрыва электрона от невозбужденного атома
в) количество энергии необходимое электрону для перехода на более высокую орбиталь
г) количество энергии, которое выделяется при присоединении электрона к нейтральному атому.
3. В главных подгруппах ПСЭ Д.И. Менделеева с увеличением заряда ядра атома восстановительные свойства элементов
а) усиливаются
б) ослабевают
в) остаются без изменений
г) сначала усиливаются, потом ослабевают
4. Наиболее ярко выраженные восстановительные свойства проявляет атом, строению внешнего электронного слоя которого соответствует формула:
а) … 3s1
б) … 4s1
в) … 4s2
г) … 5s1
5. Электроотрицательность – это:
а) способность атомов к присоединению или отдаче электронов.
б) количество энергии необходимое для отрыва электрона от невозбужденного атома.
в) количество энергии необходимое электрону для перехода на более высокую орбиталь.
г) количество энергии, которое выделяется при присоединении электрона к нейтральному атому.
6. В ряду оксидов SiO2, SO3, Cl2O7 кислотные свойства
а) усиливаются
б) ослабевают
в) остаются без изменений
г) сначала усиливаются, потом ослабевают
7. Элемент германий относится к
а) s-элементам
б) р-элементам
в) d-элементам
г) переходным металлам
8. Металлические свойства в ряду элементов 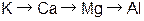 слева направо
слева направо
а) увеличиваются
б) уменьшаются
в) не изменяются
г) зависят от размера (радиуса) элемента
9. В ряду элементов  слева направо размеры (радиусы) атомов
слева направо размеры (радиусы) атомов
а) увеличиваются
б) уменьшаются
в) не изменяются
г) зависят от свойств элемента
10. Все галогены – элементы одной группы, так как их атомы имеют
а) одинаковые размеры
б) одинаковое число электронов
в) одинаковое число валентных электронов
г) одинаковую окислительную способность
ХИМИЧЕСКАЯ СВЯЗЬ
 2015-10-22
2015-10-22 2596
2596
