1. Укажите название элемента, его обозначение. Определите порядковый номер элемента, номер периода, группу, подгруппу. Укажите физический смысл параметров системы – порядкового номера, номера периода, номера группы. Обоснуйте положение в подгруппе.
2. Укажите количество электронов, протонов и нейтронов в атоме элемента, заряд ядра, массовое число.
3. Составьте полную электронную формулу элемента, определите электронное семейство, отнесите простое вещество к классу металлов или неметаллов.
4. Изобразите графически электронную структуру элемента (или двух последних уровней).
5. Графически изобразите все возможные валентные состояния.
6. Укажите число и тип валентных электронов.
7. Перечислите все возможные валентности и степени окисления.
8. Напишите формулы оксидов и гидроксидов для всех валентных состояний. Укажите их химический характер (подтвердите ответ уравнениями соответствующих реакций).
9. Приведите формулу водородного соединения.
10. Назовите область применения данного элемента
Решение. В ПСЭ элементу с порядковым номером 21 соответствует скандий 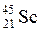 .
.
1. Элемент находится в IV периоде. Номер периода означает число энергетических уровней в атоме этого элемента, у него их 4. Скандий расположен в 3-й группе – на внешнем уровне 3-го электрона; в побочной подгруппе. Следовательно, его валентные электроны находятся на 4s- и 3d-подуровнях. Порядковый номер численно совпадает с зарядом ядра атома.
2. Заряд ядра атома скандия +21.
Число протонов и электронов – по 21.
Число нейтронов А–Z = 45 – 21 = 24.
Общий состав атома: 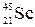 (
(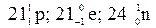 ).
).
3. Полная электронная формула скандия:
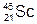 1s2 2s2 2p6 3s2 3p6 3d1 4s2 .
1s2 2s2 2p6 3s2 3p6 3d1 4s2 .
Электронное семейство: d-элемент, так как в стадии заполнения
d-орбитали. Электронное строение атома заканчивается s-электронами, поэтому скандий проявляет металлические свойства; простое вещество – металл.
4. Электронно-графическая конфигурация 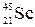 имеет вид:
имеет вид:

5. Возможные валентные состояния, обусловленные числом неспаренных электронов:
– в основном состоянии:
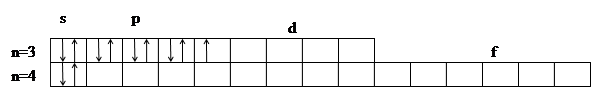
– у скандия в возбужденном состоянии электрон с 4s-орбитали перейдет на свободную 4p-орбиталь, один неспаренный d-электрон увеличивает валентные возможности скандия.

Sc имеет в возбужденном состоянии три валентных электрона.
6. Возможные валентности в данном случае определяются числом неспаренных электронов: 1, 2, 3 (или I, II, III). Возможные степени окисления (отражают число смещенных электронов) +1, +2, +3 (так как скандий – металл).
7. Наиболее характерная и устойчивая валентность III, степени окисления +3. Наличие лишь одного электрона в d-состоянии обусловливает малую устойчивость 3d14s2-конфигурации.
Скандий и его аналоги, в отличие от других d-элементов проявляет постоянную степень окисления +3, это высшая степень окисления и соответствует номеру группы.
8. Формулы оксидов и их химический характер:
форма высшего оксида – 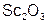 (амфотерный);
(амфотерный);
формулы гидроксидов: 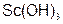 – амфотерный.
– амфотерный.
Уравнения реакций, подтверждающих амфотерный характер оксидов и гидроксидов:
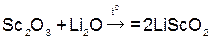 (скандат лития),
(скандат лития),
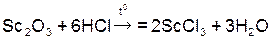 (хлорид скандия),
(хлорид скандия),
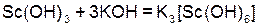 ( гексагидроксоскандиат (III) калия ),
( гексагидроксоскандиат (III) калия ),
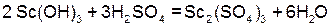 (сульфат скандия).
(сульфат скандия).
9. Соединения с водородом не образует, так как находится в побочной подгруппе и является d-элементом.
10. Соединения скандия применяются в полупроводниковой технике.
Пример 2. У какого из двух элементов, марганца или брома, сильнее выражены металлические свойства?
Решение. Данные элементы находятся в четвертом периоде. Записываем их электронные формулы:
25 Mn 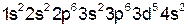
35 Br 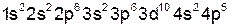
Марганец – d-элемент, т. е. элемент побочной подгруппы, а бром –
р-элемент главной подгруппы этой же группы. На внешнем электронном уровне у атома марганца только два электрона, а у атома брома – семь. Радиус атома марганца меньше радиуса атома брома при одинаковом числе электронных оболочек.
Общей закономерностью для всех групп, содержащих р- и d-элементы является преобладание металлических свойств у d-элементов.
Таким образом, у марганца металлические свойства выражены сильнее, чем у брома.
 2015-10-22
2015-10-22 2835
2835








