Идеальный газ – газ молекулы которого удовлетворяют следующим условиям:
2. Молекулы пренебрежимо малы по сравнению со средними расстояниями между ними
3. Молекулы ведут себя подобно маленьким твердым шарам. Они упруго сталкиваются между собой и со стенками сосуда. Никаких других взаимодействий между ними нет. Отсутствуют силы межмолекулярного взаимодействия.
4. Молекулы находятся в непрерывном тепловом (хаотичном) движении.
Идеального газа в природе не существует. Это физическая модель реального газа.
Уравнением состояния идеального газа называют уравнение связывающее три параметра: давление Р, объем V и температуру Т.

- уравнение Менделеева - Клапейрона

-уравнение Клапейрона
В уравнении могут меняться все пять параметров, характеризующих состояния идеального газа. Но особую роль при этом играют изопроцессы.
Изопроцессами – называют процессы, протекающие в газах при неизменном значении одного из параметров.
 -
-
это процесс изменения состояния термодинамической системы при постоянной температуре (T=const)
|
|
|
T1=T2 следовательно
P1V1=P2V2
Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
Изобарный процесс

- это процесс изменения состояния термодинамической системы при постоянном давлении (P=const).
P1=P2 следовательно
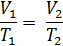
Для газа данной массы отношение объема газа к абсолютной температуре постоянно, если давление газа не меняется
Изохорный процесс

- это процесс изменения состояния термодинамической системы при по-
стоянном объеме (V = const).
V1=V2 следовательно

Для газа данной массы отношение давления газа к абсолютной температуре постоянно, если объем газа не меняется.
 2015-10-22
2015-10-22 1624
1624
