Изучение атомных спектров послужило ключом к познанию строения атома. Излучение невзаимодействующих атомов состоит из отдельных спектральных линий. Такой спектр испускания атомов называется линейчатым. Было замечено, что линии в спектре расположены не беспорядочно, а объединяются в группы или, как их называют, в серии. Линии располагаются в определенном порядке.
В 1885 г. Бальмер обнаружил, что длины волн, соответствующие линиям видимой части спектра атома водорода, могут быть точно представлены в виде
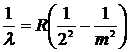
где R = 1,097∙ 107 м-1 – константа, получившая название постоянной Ридберга, работы которого были известны в области спектроскопии. Эта формула получила название формулы Бальмера, а соответствующая серия спектральных линий – серией Бальмера.
Дальнейшие опыты показали, что открытые позже линии водорода, лежащие в ультрафиолетовой (серия Лаймана) и в инфракрасной областях (серия Пашена), укладываются в аналогичные формулы. Обобщенная формула Бальмера включает все линии водородного спектра
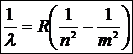 ,
,
где n = 1, 2, 3, …, причем m > n. Число n определяет серию: n = 1 – серия Лаймана, n = 2 – серия Бальмера, n = 3 - серия Пашена и т. д. Число m – номер отдельной линии в данной серии.
Установленные сериальные закономерности, универсальность постоянной Ридберга свидетельствовали о глубоком физическом смысле открытых законов. Трудно было себе представить возможность излучения целого ряда частот таким простым атомом, как атом водорода.
 2017-11-30
2017-11-30 769
769








