Эффективный диаметр молекул
В случае соударения двух одинаковых шаров минимальное расстояние между центрами шаров равно их диаметру. Поэтому эффективным диаметром молекулы d называют минимальное расстояние, на которое сближаются при соударении центры двух молекул.
Ясно, что эффективный диаметр молекулы зависит от скорости их сближения (кинетической энергии на большом расстоянии), а значит - от температуры.
Длина свободного пробега молекулы — это среднее расстояние (обозначаемое 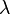 ), которое частица пролетает за время свободного пробега от одного столкновения до следующего.
), которое частица пролетает за время свободного пробега от одного столкновения до следующего.
Длина свободного пробега каждой молекулы различна, поэтому в кинетической теории вводится понятие средней длины свободного пробега (<λ>). Величина <λ> является характеристикой всей совокупности молекул газа при заданных значениях давления и температуры.
Формула
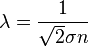 , где
, где 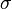 — эффективное сечение молекулы,
— эффективное сечение молекулы, 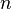 — концентрация молекул.
— концентрация молекул.
Явления переноса
Явления переноса в газах и жидкостях состоят в том, что в этих веществах возникает упорядоченный, направленный перенос массы (диффузия), импульса (внутренняя энергия) и внутренней энергии (теплопроводность). При этом в газах нарушается полная хаотичность движения молекул и распределение молекул по скоростям. Отклонениями от закона Максвелла объясняется направленный перенос физических характеристик вещества в явлениях переноса.
1. Теплопроводность.
Явление теплопроводности наблюдается, если в различных частях рассматриваемого газа температуры различны. Рассмотрение явления теплопроводности с микроскопической точки зрения показывает, что количество теплоты переносимое через площадку ΔS, перпендикулярную направлению переноса прямо пропорционально коэффициенту тепло проводимости χ, зависящему от рода вещества или газа, градиенту температуры 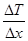 , величины площадки ΔS и времени наблюдения Δt
, величины площадки ΔS и времени наблюдения Δt
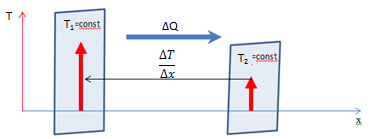
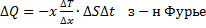
Знак минус в законе Фурье показывает, что теплота переносится в направлении убывания температуры Т.
Коэффициент теплопроводности χ равен
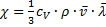
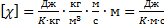
где 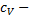 удельная теплоёмкость газа при постоянном объёме (количество теплоты, необходимое для нагревания 1 кг газа на 1 К при постоянном объёме).
удельная теплоёмкость газа при постоянном объёме (количество теплоты, необходимое для нагревания 1 кг газа на 1 К при постоянном объёме).
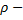 плотность газа,
плотность газа, 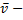 средняя скорость теплового движения молекул
средняя скорость теплового движения молекул
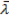
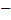 средняя длина свободного пробега.
средняя длина свободного пробега.
Диффузия
Явление диффузии заключается в самопроизвольном перемешивании молекул различных газов или жидкостей.
Рассмотрение явления самодиффузии с макроскопической точки зрения было сделано Фиком, который установил следующий закон: масса газа, переносимая через площадку ΔS, перпендикулярную к направлению переноса за время Δt прямо пропорциональна коэффициенту самодиффузии D, зависящему от рода газа, градиенту плотности 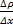 , величине площадки ΔS и времени наблюдения Δt.
, величине площадки ΔS и времени наблюдения Δt.
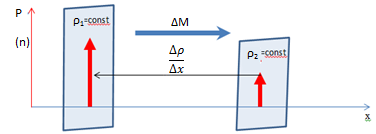
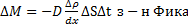
Знак минус показывает, что масса газа переносится в направлении убывания плотности. Коэффициент самодиффузии D численно равен массе газа переносимой за единицу времени через единичную площадку перпендикулярную направлению переноса, при градиенте плотности равном единице
Внутренняя энергия термодинамической системы число степеней свободы
Важной характеристикой термодинамической системы является ее внутренняя энергия U — энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т. д.) и энергия взаимодействия этих частиц. Из этого определения следует, что к внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
Внутренняя энергия — однозначная функция термодинамического состояния системы, т. е. в каждом состоянии система обладает вполне определенной внутренней энергией (она не зависит от того, как система пришла в данное состояние). Это
означает, что при переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода. В § 1 было введено понятие числа степеней свободы — числа независимых переменных (координат), полностью определяющих положение системы в пространстве. В ряде задач молекулу одноатомного газа (рис. 77, а) рассматривают как материальную точку, которой приписывают три
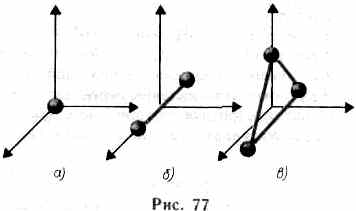
степени свободы поступательного движения. При этом энергию вращательного движения можно не учитывать (r—>0,J= mr2®0, T вр=Jw2/2®0).
В классической механике молекула двухатомного газа в первом приближении рассматривается как совокупность двух материальных точек, жестко связанных недеформируемой связью (рис. 77,б). Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси (оси, проходящей через оба атома) лишено смысла. Таким образом, двухатомный газ обладает пятью степенями свободы (i=5). Трехатомная (рис. 77,0) и многоатомная нелинейные молекулы имеют шесть степеней свободы: три поступательных и три вращательных. Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения.
Независимо от общего числа степеней свободы молекул три степени свободы всегда поступательные. Ни одна из поступательных степеней свободы не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равная 1/3значения <e0)в (43.8):
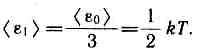
В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы
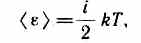
где i — сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы:
i =i пост+ i вращ+2 i колеб.
В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы.
Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа, будет равна сумме кинетических энергий NA молекул:
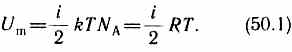
Внутренняя энергия для произвольной массы т газа
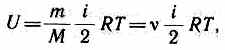
где М — молярная масса,v — количество вещества.
 2017-12-14
2017-12-14 13212
13212
