Тема: Основы молекулярно-кинетической теории
Вопросы: 1) Статистический метод в физике
2) Основное уравнение молекулярно-кинетической теории
3) Внутренняя энергия газа
4) Явления переноса
1. Молекулярная физика и термодинамика - разделы физики, в которых изучается макроскопические процессы в телах, связанные с огромным числом содержащихся в них атомов и молекул. Для исследования этих процессов применяют два качественно различных и взаимно дополняющих друг друга метода: статический (молекулярно-кинетический) и термодинамический. В основе молекулярной физики лежит статический метод
Молекулярная физика раздел физики, в котором изучаются строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.
Движение молекул в разных телах происходит по-разному. Молекулы газов беспорядочно движутся с большими скоростями (сотни м/с) по всему объему газа. Сталкиваясь, они отскакивают друг от друга, изменяя величину и направление скоростей. Молекулы жидкости колеблются около равновесных положений (т.к. расположены почти вплотную друг к другу) и сравнительно редко перескакивают из одного равновесного положения в другое случайным образом. Движение молекул в жидкостях является менее свободным, чем в газах, но более свободным, чем в твердых телах. В твердых телах частицы сильно связаны, поэтому только колеблются около положения равновесия. Между ними действуют силы притяжения и отталкивания (см. рис.).
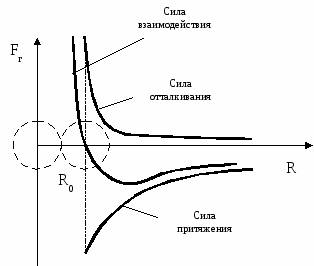
При образовании кристалла из раствора или расплава молекулы (атомы, ионы) занимают положения, в которых эти силы уравновешивают друг друга (расстояние R0) между частицами.
С ростом температуры скорость частиц увеличивается, поэтому хаотическое движение частиц принято называть тепловым.
Модель идеального газа – твёрдые шарики одного диаметра, взаимодействующие между собой только при столкновении. В момент столкновения молекула резко изменяет величину и направление скорости своего движения. Расстояние, проходимое молекулой в среднем без столкновений, называется средней длиной свободного пробега.
Скорости молекул газа имеют различные значения и направления, причем из-за огромного числа соударений, которые ежесекундно испытывает молекула, скорость ее постоянно изменяется. В этом случае не имеет смысла применять динамический метод, основанный на законах Ньютона - нельзя определить число молекул, которые обладают точно заданной скоростью v в данный момент времени. Максвелл разработал статистический метод, по которому можно подсчитать долю молекул, скорости которых имеют значение, лежащие между некоторыми скоростями v 1 и v 2. На основании теории вероятности Максвелл установил закономерность (функцию f(v)), по которой можно определить долю от общего числа молекул газа N, скорости которых при данной температуре заключены в интервале скоростей от v до v + dv:
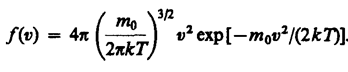
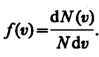
, где
Видно, что конкретный вид функции зависит от рода газа (от массы молекулы m0) и от параметра состояния (температуры Т). В формуле k – постоянная Больцмана, равная 1, 38·10 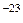 Дж/К.
Дж/К.
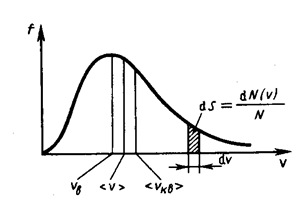
Распределение Максвелла достигает максимума при наиболее вероятной скорости 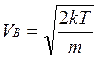 , т.е. такой скорости, к которой близки скорости большинства молекул. Здесь m – масса одной молекулы газа.
, т.е. такой скорости, к которой близки скорости большинства молекул. Здесь m – масса одной молекулы газа.
Площадь заштрихованной полоски с основанием dV покажет, какая часть от общего числа молекул имеет скорости, лежащие в данном интервале. Конкретный вид функции распределения Максвелла зависит от рода газа (массы молекулы) и температуры. Давление и объем газа на распределение молекул по скоростям не влияет. С повышением температуры наиболее вероятная скорость возрастает, поэтому максимум распределения молекул по скоростям сдвигается в сторону больших скоростей, а его абсолютная величина уменьшается, т.к. общее число молекул (площадь под кривой) не изменяется (см. рисунок ниже).
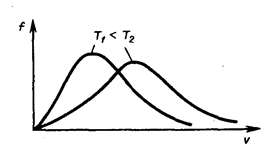
Следовательно, при нагревании газа доля молекул, обладающих малыми скоростями уменьшается, а доля молекул с большими скоростями увеличивается.
Таким образом, в газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону. Из него вытекает также, что как бы ни изменялись скорости молекул при столкновениях, средняя квадратичная скорость молекул массой т 0 в газе, находящемся в состоянии равновесия при Т = const. остается постоянной и равной 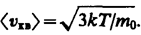
Распределение Максвелла позволяет найти среднюю арифметическую скорость молекул:
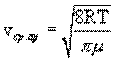 .
.
При комнатной температуре T=300K средняя арифметическая скорость молекул кислорода будет равна ≈500 м/с.
Первое экспериментальное определение скоростей молекул было осуществлено Штерном в 1920 г: подтвердилась правильность оценки средней скорости молекул, вытекающей из распределения Максвелла.
Экспериментальная установка представляет собой два находящихся в вакууме жестко связанных между собой коаксиальных цилиндра (см. рис.), по оси которых натянута платиновая нить, покрытая серебром. Малый цилиндр радиуса r имеет вертикальную щель.
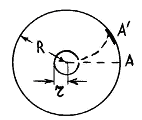
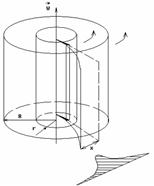
Если по нити пропустить электрический ток, она будет нагреваться, серебро будет испарятся, его атомы будут пролетать через щель и осаждаться на большом цилиндре радиуса R, образуя изображение узкой щели в виде узкой полоски почернения серебра. Картина изменится, если установку привести во вращение с угловой скоростью w, при этом полоска смещается в сторону противоположную вращению на величину 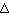 =AA'. Смещение возникало, потому что за время t пролета атомом серебра расстояния R-r цилиндр успевал повернуться на угол
=AA'. Смещение возникало, потому что за время t пролета атомом серебра расстояния R-r цилиндр успевал повернуться на угол 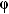 =
= 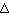 /R =
/R = 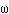 t. Откуда определялось время t =
t. Откуда определялось время t = 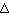 /
/ 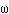 R, знание которого позволяло найти скорость атома серебра через измеримые параметры опыта:
R, знание которого позволяло найти скорость атома серебра через измеримые параметры опыта:
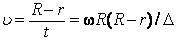
Как следовало ожидать, полоска серебра в положении А' оказывалась размытой из-за того, что атомы серебра имеют разные скорости: более быстрым атомам соответствуют меньшие, а более медленным – большие смещения  . Исследуя зависимость плотности серебра в размытой части от расстояния до точки A, нетрудно оценить распределение атомов серебра по скоростям. Полученное распределение хорошо согласовывалось со значениями, вычисленными по формуле Максвелла.
. Исследуя зависимость плотности серебра в размытой части от расстояния до точки A, нетрудно оценить распределение атомов серебра по скоростям. Полученное распределение хорошо согласовывалось со значениями, вычисленными по формуле Максвелла.
Применяя статистический метод, Больцман получил распределение молекул газа в гравитационном поле:
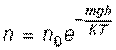 ,
,
где n – число молекул газа в единице объема (концентрация) на высоте h, n0 – концентрация молекул газа на нулевом уровне (уровне земли)
Больцман показал, что полученное распределение применимо к идеальному газу, находящемуся в любом силовом поле.
2. Результаты экспериментальных и теоретических исследований позволили уже в девятнадцатом веке сформулировать основные положения молекулярно-кинетической теории для газов:
· газ состоит из молекул (мельчайших частиц, размеры которых порядка 10-10 м);
· молекулы газа находятся в непрерывном хаотическом движении;
· молекулы сталкиваются друг с другом. Столкновения бывают упругими (низкие температуры) и неупругими (высокие температуры);
· в промежутке между соударениями молекулы движутся прямолинейно;
· молекулы на малых расстояниях отталкиваются, а на больших притягиваются друг к другу.
Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа. В модели идеального газа предполагается следующее: молекулы обладают пренебрежимо малым объемом по сравнению с объемом сосуда, между молекулами не действуют силы притяжения, при соударениях молекул друг с другом и со стенками сосуда действуют силы отталкивания.
При упругом столкновении молекулы со стенкой сосуда проекция vх вектора скорости на ось ОХ, перпендикулярную стенке, изменяет свой знак на противоположный, но остается постоянной по модулю (см.рис).
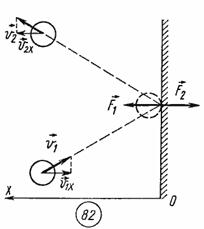
Поэтому в результате столкновения молекулы со стенкой проекция ее импульса на ось ОХ изменяется от mv1х = - mvх до mv2х = mvх. Изменение импульса молекулы показывает, что на нее при столкновении действует сила 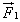 , направленная от стенки. Изменение импульса молекулы равно импульсу силы:
, направленная от стенки. Изменение импульса молекулы равно импульсу силы:
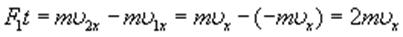 .
.
Во время столкновения молекула действует на стенку с силой 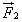 , равной по третьему закону Ньютона силе
, равной по третьему закону Ньютона силе 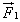 по модулю и направленной противоположно.
по модулю и направленной противоположно.
Молекул газа очень много, и удары их о стенку следуют один за другим с очень большой частотой. Среднее значение геометрической суммы сил, действующих со стороны отдельных молекул при их столкновениях со стенкой сосуда, и является силой давления газа. Давление газа равно отношению модуля силы давления 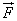 к площади стенки S:
к площади стенки S:
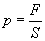 .
.
На основе использования основных положений молекулярно-кинетической теории было получено уравнение, которое позволяет вычислить давление газа, если известны масса m молекулы газа, среднее значение квадрата скорости молекул 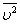 и концентрация n молекул:
и концентрация n молекул:
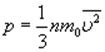
Среднее значение кинетической энергии молекул идеального газа
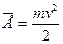 , получим
, получим 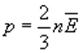 .
.
Давление идеального газа равно двум третям средней кинетической энергии движения молекул, содержащихся в единице объема.
Опыт показывает, что давление и температура газа связаны, поэтому английским физиком Кельвином была введена абсолютная температура Т как мера средней энергии движения молекул вещества:
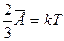
Здесь k - постоянная Больцмана, k = 1,38*10-23 Дж/К. За ноль абсолютной температуры принята такая температура по шкале Кельвина, при которой прекращается всякое движение молекул вещества, т.е. 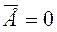 .
.
Связь температур, измеряемых в шкале Кельвина Т и шкале Цельсия t, имеет вид
Т = t + 273.
В результате было получено выражение, связывающее давление и температуру идеального газа
p= nkT,
которое называется основным уравнением молекулярно-кинетической теории газа.
В результате преобразования этого выражения было получено уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
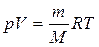 ,
,
где универсальная газовая постоянная R = 8,31 Дж/(моль·К), М - молярная масса газа, m – масса газа, V – объем газа.
Основной закон молекулярно-кинетической теории позволил рассчитать среднюю длину свободного пробега молекул газа между соударениями
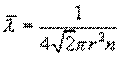
r– размер молекулы, n – число молекул в единице объема газа.
В воздухе при нормальных условиях (давление 1 атм, температура 273 К) средняя длина свободного пробега молекулы составляет порядка 0,6 ·10 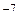 м, при этом в единице объема газа каждую секунду совершается порядка 8,6·10
м, при этом в единице объема газа каждую секунду совершается порядка 8,6·10  столкновений молекул.
столкновений молекул.
3. Молекулы можно рассматривать как системы материальных точек (атомов) совершающих как поступательное, так и вращательное движения. При исследовании движения тела необходимо знать его положение относительно выбранной системы координат. Для этого вводится понятие о степенях свободы тела. Число независимых координат, которые полностью определяют положение тела в пространстве, называется числом степеней свободы тела.
При движении точки по прямой линии для оценки ее положения необходимо знать одну координату, т.е. точка имеет одну степень свободы. Если точка движения по плоскости, ее положение характеризуется двумя координатами; при этом точка обладает двумя степенями свободы. Положение точки в пространстве определяется 3 координатами. Число степеней свободы обычно обозначают буквой i. Молекулы, которые состоят из обычного атома, считаются материальными точками и имеют три степени свободы (аргон, гелий).
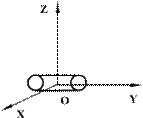
Двухатомные жесткие молекулы, например молекулы водорода, азота и др., обладают пятью степенями свободы: они имеют 3 степени свободы поступательного движения и 2 степени свободы вращения вокруг осей ОХ и OZ (см.рис.). Вращением вокруг оси OY можно пренебречь, т.к. момент инерции ее относительно этой оси пренебрежимо мал. Поэтому вклад энергии вращательного движения вокруг оси OY в суммарную энергию двухатомной молекулы можно не учитывать.
Молекулы, состоящие из трех и более жестко связанных атомов, не лежащих на одной прямой, имеют число степеней свободы i = 6: три степени свободы поступательного движения и 3 степени свободы вращения вокруг осей ОХ, OY и OZ.
В случае, если расстояние между атомами может изменяться (атомы совершают колебания у положения равновесия), появляются дополнительные степени свободы. Согласно молекулярно-кинетической теории газов движение молекул носит беспорядочный характер; эта беспорядочность относится ко всем видам движения молекулы. Ни один из видов движения не имеет преимущества перед другим. При статистическом равновесии движений энергия в среднем распределяется равномерно между всеми видами движения. Закон равномерного распределения энергии по степеням свободы молекул можно сформулировать следующим образом: статистически в среднем на каждую степень свободы молекул приходится одинаковая энергия.
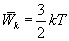 . Поступательное движение молекул характеризуется средней кинетической энергией, равной
. Поступательное движение молекул характеризуется средней кинетической энергией, равной
Так как поступательному движению соответствует 3 степени свободы, то в среднем на одну степень свободы движения молекул приходится энергия
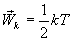
В однородном газе, молекулы которого имеют любое число степеней свободы i, каждая молекула в среднем обладает энергией движения, равной
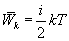
В теории идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется кинетической энергией хаотического (теплового) движения всех его молекул.
Так как в одном моле любого вещества содержится NА (число Авогадро
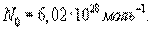 ) молекул, то внутренняя энергия одного моля газа будет
) молекул, то внутренняя энергия одного моля газа будет
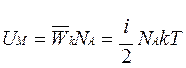
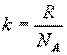 Учитывая, что получим
Учитывая, что получим 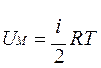 , здесь R=8,31 Дж/(моль·К) – универсальная газовая постоянная.
, здесь R=8,31 Дж/(моль·К) – универсальная газовая постоянная.
Для любой массы m газа с молярной массой М, т.е. для любого числа молей формула для внутренней энергии имеет вид
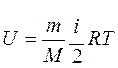
Из этого выражения следует, что внутренняя энергия является однозначной функцией состояния и, следовательно, при совершении системой любого процесса, в результате которого система возвращается в исходное состояние, полное изменение внутренней энергии равно нулю.
4. Беспорядочное тепловое движение молекул, непрерывные столкновения между ними приводят к тому, что молекулы, хотя и сравнительно медленно, перемещаются из одной точки пространства в другую. В результате столкновения изменяются величины и направления скоростей молекул, что приводит к передаче импульса и энергии. По этой причине в газовой среде, если рассматривать бесконечно малые объемы отдельных участков среды, самопроизвольно возникают флуктуации плотности (концентрации), температуры и давления газа, которые мгновенно исчезают. Если данные неоднородности вызваны посторонним источником и носят постоянный характер, то хаотическое движение молекул стремится ликвидировать эти неоднородности. При этом в газе возникают особые процессы, которые носят название явлений переноса. К ним относятся диффузия, теплопроводность и внутреннее трение.
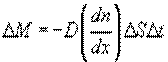 Диффузия. Если в локальном объеме распределена примесь другого газа (или увеличена плотность данного газа), то хаотическое движение молекул будет способствовать выравниванию концентрации газовых молекул. Процесс выравнивания концентрации газовых молекул называется диффузией. Наблюдения показывают, что в процессе диффузии через площадь поверхности
Диффузия. Если в локальном объеме распределена примесь другого газа (или увеличена плотность данного газа), то хаотическое движение молекул будет способствовать выравниванию концентрации газовых молекул. Процесс выравнивания концентрации газовых молекул называется диффузией. Наблюдения показывают, что в процессе диффузии через площадь поверхности 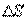 , расположенную нормально оси, вдоль которой происходит изменение концентрации вещества за время
, расположенную нормально оси, вдоль которой происходит изменение концентрации вещества за время  , переносится масса вещества
, переносится масса вещества 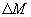 , пропорциональная градиенту концентрации
, пропорциональная градиенту концентрации 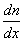 , площади
, площади 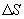 и времени
и времени 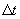
Это уравнение выражает закон Фика. Величина D называется коэффициентом диффузии. Знак минус означает, что масса переносится в сторону убывания концентрации. С точки зрения молекулярно-кинетической теории
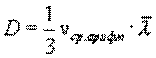
Таким образом, коэффициент диффузии определяется средней длиной свободного пробега 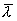 и средней арифметической скоростью
и средней арифметической скоростью 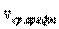 молекул.
молекул.
Теплопроводность. В случае неодинаковых температур в различных частях газа те молекулы, которые находятся в более теплых областях, в среднем обладают большей кинетической энергией, чем молекулы в более холодных областях. И здесь молекулярное движение сопровождается суммарным переносом энергии в направлении более холодных частей газа, вследствие чего происходит выравнивание температуры. Этот процесс называется теплопроводностью. Явление теплопроводности заключается в переносе теплоты 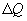 от более горячего слоя с температурой
от более горячего слоя с температурой 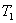 к более холодному, температура которого
к более холодному, температура которого 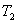 , Закон теплопроводности был сформулирован Фурье: теплота
, Закон теплопроводности был сформулирован Фурье: теплота 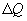 переносимая через элемент площади
переносимая через элемент площади 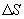 за время
за время 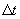 , пропорциональна градиенту температуры
, пропорциональна градиенту температуры 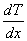 , площади
, площади 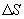 и времени
и времени 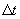 :
:
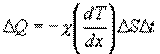
где χ - коэффициент теплопроводности, он зависит от среднеарифметической скорости молекул и плотности газа (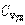 - удельная теплоемкость газа):
- удельная теплоемкость газа):
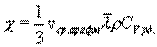
Внутреннее трение. Если два соприкасающихся слоя движутся с различными скоростями, то может происходить выравнивание скоростей слоев газов. В среднем импульсы молекул таких слоев различны - молекулы более быстрых слоев имеют большие значения импульсов. Переход молекул из быстрых слоев в более медленный сопровождается переносом импульса упорядоченного движения. Противоположное по характеру действие оказывают молекулы медленного слоя, перешедшие в быстрый слой, - в этом слое возникают тормозящие силы. Суммарный эффект при этом - выравнивание скоростей слоев. Это явление называется внутренним трением. При этом закон внутреннего трения гласит: сила вязкости F пропорциональна градиенту скорости 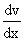 и площади S соприкасающихся слоев:
и площади S соприкасающихся слоев:
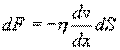
где η - коэффициент внутреннего трения (динамическая вязкость). С точки зрения молекулярно-кинетической теории
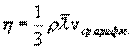
 2015-04-23
2015-04-23 824
824








