Чтобы понять, каким образом при ядерных реакциях освобождается колоссальное количество энергии, заключенной в ядрах атомов, необходимо знать строение атома и его ядра.
Атом – это наименьшая частица химического элемента. Он состоит из положительно заряженного ядра, вокруг которого вращаются отрицательно заряженные частицы – электроны, составляющие электронную оболочку атома (рис. 1).
Электрон – это элементарная частица с массой покоя, равной 0,000548 а. е. м. (1 а. е. м. = 1,66 × 10–27 кг).
Заряд электрона е = 1,602 × 10–19 Кл.
Электроны в атомах могут двигаться без потери энергии только по определенным орбитам (рис. 2). Количество орбит, по которым вращаются электроны, может быть произвольно, но они группируются в электронные слои. Слоев может быть семь: K, L, М, N, O, P, Q.

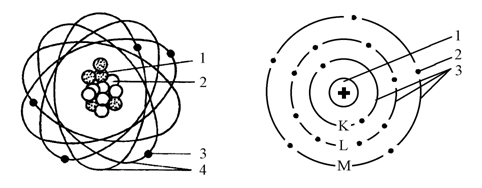
Рис. 1. Строение атома: Рис. 2. Схема атомных
1 – протон; 2 – нейтрон; электронных оболочек:
3 – электрон; 4 – орбиты 1 – ядро; 2 – электроны;
Каждый слой содержит строго определенное число электронов. Чем он ближе к ядру, тем выше энергия связи с ядром, и наоборот. Поэтому электроны с орбит внешних электронных слоев сорвать значительно легче, чем с орбит внутренних электронных слоев. Переход электрона с ближайшей к ядру орбиты на более удаленную происходит с поглощением порции (кванта) энергии. При возвращении электрона на ближайшую орбиту происходит выделение такого же количества энергии.
Ядро при аналогичных переходах излучает гамма-кванты. Как и для всякой системы, наибольшая энергетическая устойчивость атома соответствует его наименьшей энергии. Состояние атома с наименьшей энергией называется нормальным, или основным, ему соответствует нахождение электрона на ближайшей к ядру, нормальной орбите.
В нормальном, т. е. устойчивом, состоянии атом не выделяет и не поглощает энергии. При воздействии на атом, например рентгеновскими лучами, происходит возбуждение атома, т. е. один из электронов переходит на какую-либо из внешних орбит, в результате чего энергия атома увеличивается.
Возбужденный атом неустойчив, поэтому он через очень короткий промежуток времени (миллионные доли секунды) вновь возвращается в устойчивое состояние, при этом восстанавливается первоначальная структура электронной оболочки.
При переходе атома в энергетически более устойчивое состояние освобождается энергия в виде фотона – элементарной частицы, электромагнитного излучения (видимого света, ультрафиолетового или рентгеновского излучения).
Обычно атом электрически нейтрален, т. к. суммарный отрицательный заряд всех электронов по абсолютной величине равен заряду ядра. Если увеличить энергию, передаваемую электрону, то он может оторваться от атома, в результате чего атом превращается в положительно заряженный ион. Этот процесс называется ионизацией. На ионизацию атома затрачивается энергия, равная энергии связи электрона в атоме. Обратный процесс, т. е. захват положительно заряженным ионом свободного электрона, называется рекомбинацией: при этом выделяется энергия, равная энергии связи электрона с ядром.
Ядро – центральная часть атома, в которой сосредоточена практически вся масса атома и его положительный электрический заряд.
Ядро состоит из протонов – положительно заряженных частиц (р) и нейтронов (n), частиц, не имеющих заряда. Обе частицы, протоны и нейтроны, носят общее название – нуклоны. Диаметр ядра составляет примерно 10–15 м. Плотность вещества в ядре 2´1014 г/см3, т. е. 1 см3 ядерного вещества имеет массу 108 т.
Протон (от греч. Protos – первый) – это элементарная частица, она имеет положительный заряд, равный по абсолютной величине заряду электрона е = 1,602´10–19 Кл, и массу покоя m p = 1,6726´10–27 кг = = 1836 mе. Зарядом протонов объясняется положительный заряд ядра в целом.
Нейтрон – нейтральная элементарная частица, которая не имеет электрического заряда, он чуть тяжелее протона и имеет массу покоя mn = 1,6748´10–27 кг = 1839 mе. Поэтому, хотя ядро в десятки тысяч раз меньше атома, в нем сосредоточена почти вся масса атома.
Масса ядра определяется суммарным количеством нуклонов (протонов и нейтронов), а заряд ядра равен сумме зарядов входящих в его состав протонов. Число, равное общему количеству нуклонов и характеризующее массу ядра, называется массовым числом (А), которое численно равно общему числу протонов (Z) и нейтронов (N), входящих в состав ядра А = Z + N. Заряд же ядра, выраженный в элементарных единицах, численно равен порядковому номеру элемента в периодической таблице Д. И. Менделеева и называется зарядовым числом ядра. Поскольку Z выражает число протонов, а А число нуклонов в ядре, то число нейтронов в атомном ядре N = А – Z.
Для химических элементов принято следующее обозначение 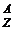 Х: слева вверху у символа химического элемента пишется массовое число, а внизу – зарядовое число. Например, изотоп плутония
Х: слева вверху у символа химического элемента пишется массовое число, а внизу – зарядовое число. Например, изотоп плутония 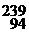 Pu означает, что массовое число А = 239, зарядовое число Z = 94, число нейтронов N = А – Z.
Pu означает, что массовое число А = 239, зарядовое число Z = 94, число нейтронов N = А – Z.
В ядре атома каждого химического элемента находится строго определенное количество протонов. Например, в ядре атома водорода содержится 1 протон, в ядре атома He – 2 протона, Li – 3 протона и т. д. Число же нейтронов в ядрах атомов одного и того же химического элемента может быть различным.
Атомы одного и того же элемента с одинаковым числом протонов, но с различным числом нейтронов в ядре называются изотопами. Электронные оболочки изотопов одного и того же химического элемента одинаковые. Поэтому изотопы имеют одинаковые химические свойства и располагаются в одной клетке периодической таблицы Менделеева.
Большинство химических элементов состоит из нескольких изотопов. Так, наряду с обычным водородом существует тяжелый водород (дейтерий), ядро которого содержит один протон и нейтрон, а также сверхтяжелый водород (тритий), ядро которого содержит протон и два нейтрона (рис. 3).
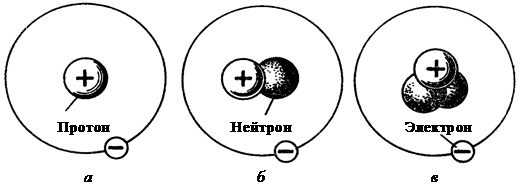
Рис. 3. Схема строения атомов изотопов водорода:
а – водород; б – дейтерий; в – тритий
Изотопы водорода отличаются друг от друга по массе в два или три раза. Дейтерий нерадиоактивен, входит в качестве небольшой смеси в обычный водород. При соединении дейтерия с кислородом образуется тяжелая вода, ее физические свойства заметно отличаются от свойств обычной воды. При нормальном атмосферном давлении она кипит при 101,2°С и замерзает при – 3,8°С. Тритий имеет атомную массу 3, он бета-активен, с периодом полураспада 12 лет.
Смесью трех изотопов является природный уран, который состоит из U-238 (99,28%), U-235 (0,714%), U-234 (0,006%), ядра этих изотопов содержат соответственно 146, 143 и 142 нейтрона.
Всего известно около 2000 естественных и искусственно полученных радиоактивных изотопов. Некоторые изотопы, встречающиеся в природе, и почти все изотопы, которые получены искусственным путем, не могут существовать сколь угодно долго. Такие неустойчивые изотопы принято называть радионуклидами.
Термин «изотопы» следует применять только в тех случаях, когда речь идет об атомах одного и того же химического элемента. Если подразумеваются атомы разных химических элементов, рекомендуется использовать термин «нуклиды».
Например, смесь радионуклидов Sr-90, I-131, Cs-137, но изотопы углерода С-12, С-14. Природный калий представлен тремя изотопами: К-39, К-40, К-41; соответственно, 93,08%, 0,0119% и 6,91%.
Атомные ядра с одинаковым массовым числом А и разным Z называются изобарами, а с одинаковым числом нейтронов N (N = A – Z) называют изотонами.
Например: ядра 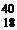 Ar,
Ar, 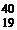 K,
K, 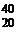 Ca – изобары (для них А = 40);
Ca – изобары (для них А = 40);
а ядра 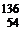 Хе,
Хе, 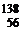 Ва,
Ва, 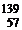 La – изотоны (для них N = 82).
La – изотоны (для них N = 82).
Существование изотопов доказывает, что заряд ядра определяет не все свойства атома, а лишь его химические свойства и те физические свойства, которые зависят от электронной оболочки, например размеры. Масса же атома и его радиоактивные свойства не определяются порядковым номером в таблице Менделеева.
 2017-12-14
2017-12-14 2612
2612
