|
| | разложение
|
|
H2SiO3  SiO2 + H2O
H2CO3→ H2O+CO2
4НNO3 SiO2 + H2O
H2CO3→ H2O+CO2
4НNO3  4NO2+2H2O+O2
H2SO4 4NO2+2H2O+O2
H2SO4  SO3 + H2O
H2SO3=H2O+SO2
НСООН = H2О + CO
H2S=H2+S SO3 + H2O
H2SO3=H2O+SO2
НСООН = H2О + CO
H2S=H2+S
|
|
| 2. Взаимодействие с любыми основаниями и амфотерными гидроксидами:
H2SO4 + Ca(OH)2 ® CaSO4¯ + 2H2O
H2SO4 + Zn(OH)2 ® ZnSO4 + 2H2O
Взаимодействие кислоты с недостатком основания (образуется кислая соль):
KOH + H2SO4 = KHSO4 + H2O
Взаимодействие кислоты с избытком основания (образуется средняя соль):
2KOH + H2SO4 = K2SO4 + 2H2O
|
|
| 3. Взаимодействие со всеми основными и амфотерными оксидами:
H2SO4 + CaO ® CaSO4¯ + H2O 2H+ + SO42– + CaO ® CaSO4¯ + H2O
H2SO4 + ZnO ® ZnSO4 + H2O 2H+ + ZnO ® Zn2+ + H2O.
|
|
4. Взаимодействие с металлами: а) кислоты-окислители по Н+ (HCl, HBr, HI, HClO4, H2SO4 (разб.), СH3 СООН, H3PO4 и др.).
Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H2) Cu Hg Ag Pt Au
Металл, находящийся левее водорода, способен вытеснять из кислоты в растворе водород.
Mg + 2HCl = MgCl2 + H2
Zn0 + H2+1SO4(разб) → Zn+2SO4 + H20↑
Нюансы:
1. Образующаяся соль должна быть растворима. В ином случае нерастворимая соль обволакивает частицы металла, затрудняя доступ кислоты к металлу, и реакция прекращается. Pb 0 + H2+1SO4(разб) ≠ Pb+2SO4↓+ H20↑
2. В реакциях с азотной и с концентрированной серной кислотами способны участвовать и металлы, стоящие правее водорода в электрохимическом ряду напряжений металлов. Но водород в этих реакциях не выделяется!
2. Серная кислота окисляет неметаллы:
| неМе + H2SO4(конц.) = H2O + SO2 + кислородсодержащая кислота неМе ,
здесь степень окисления неМе – высшая (равна номеру группы)
| C + 2H2SO4 = 2H2O + CO2 + 2SO2
S + 2H2SO4 = 3SO2 + 2H2O
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O
3. Взаимодействие серной кислоты с металлами:
H2SO4 (конц.) + Me = соль + H2O + Х
|
| Щелочные
и щелочноземельные
| Fe, Cr, Al
| Металлы
до водорода
Сd-Pb
| Металлы после
водорода (при t)
| Au, Pt, Pd
| | X
| H2S↑
могут S↓ или SO2↑
8Na + 5H2SO4 = =4Na2SO4 + H2S+ +4H2O
| 1) пассивируются на холоде (не реагируют, покрываются защитной оксидной пленкой);
2) при нагревании → SO2↑
| S↓
могут H2Sили SO2
| SO2↑
| -
|
|
|
При взаимодействии азотной кислоты с металлами никогда не выделяется водород
HNO3 + Me = соль + H2O + Х
| | Щелочные и щелочноземельные
| Fe, Cr, Al, Ni, Co
| Металлы до водорода
| Металлы после водорода
(Cu и др)
| Благородные
Au, Pt, Os, Ir,Ta
| | HNO3(конц.ω>60%)
| N2O
| пассивация (при обычных условиях);
NO2 (при нагревании)
| NO2
| NO2
| Нет реакции
| | HNO3(разбавл.)
| NH3, NH4NO3
4Са +10HNO3(разб) = =4Ca(NO3)2 + +NH4NO3 + 3H2O
| Основной NO, но в зависимости от разбавления могут образовываться N2, N2O, NH3, NH4NO3. Чем больше разбавлена кислота, тем ниже степень окисления азота.
| NO
|
|
|
| ←увеличение концентрации кислоты
NO2,NO,N2O,N2,NH4NO3
→ увеличение активности металла
Кремний устойчив к действию многих кислот, в кислой среде он покрывается нерастворимой пленкой оксида и пассивируется. Кремний взаимодействует только со смесью плавиковой и азотной кислот:
3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O.
Но возможны реакции с галогеноводородами
С фтороводородом реагирует при обычных условиях:
Si + 4HF = SiF4 + 2H2,
с хлороводородом – при 300 °С, с бромоводородом – при 500 °С.
|
|
Серная кислота окисляет HI и НВг до свободных галогенов:
H2SO4 + 2HI = I2 + 2H2O + SO2.
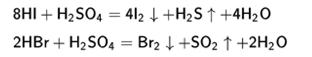
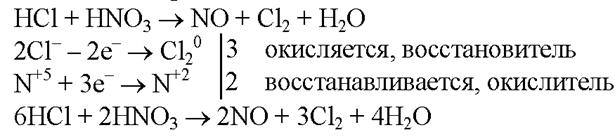
|
|
| Серная кислота отнимает химически связанную воду от органических соединений, содержащих гидроксильные группы. Дегидратация этилового спирта в присутствии концентрированной серной кислоты приводит к получению этилена:
С2Н5ОН = С2Н4 + Н2О.
Обугливание сахара, целлюлозы, крахмала и др. углеводов при контакте с серной кислотой объясняется также их обезвоживанием:
C6H12O6 + 12H2SO4 = 18H2O + 12SO2↑ + 6CO2↑.
|
|
|
|
|
| Царская водка: V(HNO3): V(HCl) = 1: 3 растворяет благородные металлы.
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O
4HNO3 + 18HCl + 3Pt = 3H2[PtCl6] + 4NO + 8H2O
4. Азотная кислота реагирует с неметаллами.
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
S + 2HNO3 = 2NO + H2SO4.
3I2 + 10HNO3 ® 6HIO3 + 10NO + 2H2O
C + 4HNO3 = CO2 + 4NO2 + 2H2O.
B0 + 3HNO3 → H3B+3O3 + 3NO2
5HNO3(конц.)+P(красн.)=H3PO4+5NO2+H2O
3P0 + 5HNO3 (разб)+ 2H2O → 5NO + 3H3P+5O4
|
|
| прочие реакции
|
|
|
С оксидами неметаллов (особые реакции): СO + H2SO4 = CO2 + SO2 + H2O
|
|
| | | |
особые свойства сероводорода
H2S-2 + Br2 → S0 + 2HBr
H2S-2 + 2FeCl3 → 2FeCl2 + S0 + 2HCl
H2S-2 + 4Cl2 + 4H2O → H2S+6O4 + 8HCl
3H2S-2 + 8HNO3(конц) → 3H2S+6O4 + 8NO + 4H2O
H2S-2 + H2S+6O4(конц) → S0 + S+4O2 + 2H2O
(при нагревании реакция идет по - иному:
H2S-2 + 3H2S+6O4(конц) → 4S+4O2 + 4H2O
4) Сероводород окисляется:
при недостатке O2
2H2S-2 + O2 → 2S0 + 2H2O
при избытке O2
2H2S-2 + 3O2 → 2S+4O2 + 2H2O
5) Серебро при контакте с сероводородом чернеет:
4Ag + 2H2S + O2 → 2Ag2S↓ + 2H2O
 SiO2 + H2O
H2CO3→ H2O+CO2
4НNO3
SiO2 + H2O
H2CO3→ H2O+CO2
4НNO3  4NO2+2H2O+O2
H2SO4
4NO2+2H2O+O2
H2SO4  SO3 + H2O
H2SO3=H2O+SO2
НСООН = H2О + CO
H2S=H2+S
SO3 + H2O
H2SO3=H2O+SO2
НСООН = H2О + CO
H2S=H2+S
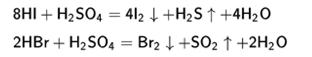
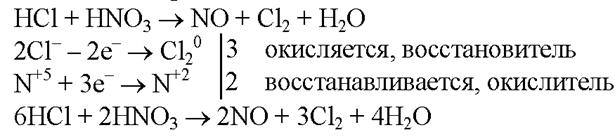

 2017-12-14
2017-12-14 512
512






