1.1. Тепловые процессы при кристаллизации. Любое вещество может находиться в одном из четырех агрегатных состояний: твердом, жидком, газообразном и плазменном. Агрегатное состояние определяется энергией взаимодействия атомов. Стабильным (равновесным) при определенных внешних условиях является состояние вещества, при котором оно обладает минимумом свободной энергии. Свободная энергия — часть внутренней энергии вещества. Внутренняя энергия вещества — это сумма потенциальной энергии (энергии взаимодействия) и кинетической энергии частиц (тепловые колебания). Часть внутренней энергии, высвобождающаяся при переходе вещества из одного состояния в другое, называется свободной энергией. Чем больше высвободится свободной энергии, тем меньшей энергией будет обладать вещество, тем более стабильно его состояние. Свободную энергию можно представить как аналог потенциальной энергии (рис. 1).
 В положении 1 шарик имеет максимальную потенциальную энергию. Это положение не является устойчивым, шарик скатывается в положение 2, при котором его потенциальная энергия будет равна 0. Вещество может находиться в метастабильном состоянии (закаленная сталь). Такое состояние не обладает минимумом свободной энергии, но является достаточно устойчивым (стабильным). Вещество в метастабильном состоянии может находиться бесконечно долго при условии постоянства внешних факторов.
В положении 1 шарик имеет максимальную потенциальную энергию. Это положение не является устойчивым, шарик скатывается в положение 2, при котором его потенциальная энергия будет равна 0. Вещество может находиться в метастабильном состоянии (закаленная сталь). Такое состояние не обладает минимумом свободной энергии, но является достаточно устойчивым (стабильным). Вещество в метастабильном состоянии может находиться бесконечно долго при условии постоянства внешних факторов.
 Кристаллизация — это переход металла из жидкого состояния в твердое состояние с образованием кристаллического строения. Это первичная кристаллизация (в отличие от вторичной, когда кристаллы металлических фаз выделяются из твердого вещества). Рассмотрение кристаллизации для металлов и сплавов на их основе связано с тем, что эти материалы получают методом литья, тогда как многие неметаллические материалы производят другими способами. Ряд неметаллических материалов существует в природном виде (углерод), многие химические соединения получают путем химических реакций: карбиды — карбидизацией, нитриды — азотированием и т.п.
Кристаллизация — это переход металла из жидкого состояния в твердое состояние с образованием кристаллического строения. Это первичная кристаллизация (в отличие от вторичной, когда кристаллы металлических фаз выделяются из твердого вещества). Рассмотрение кристаллизации для металлов и сплавов на их основе связано с тем, что эти материалы получают методом литья, тогда как многие неметаллические материалы производят другими способами. Ряд неметаллических материалов существует в природном виде (углерод), многие химические соединения получают путем химических реакций: карбиды — карбидизацией, нитриды — азотированием и т.п.
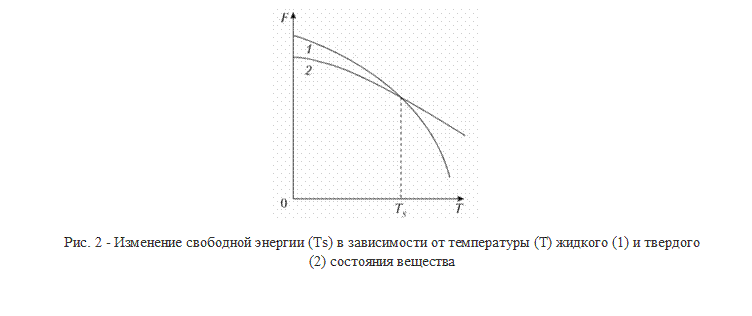
Процесс кристаллизации (затвердевания) обусловлен стремлением системы к переходу в более устойчивое термодинамическое состояние. При изменении внешних условий, например температуры, свободная энергия системы меняется различно для жидкого и твердого (кристаллического) состояния (рис. 2). Выше температуры Ts более стабильным является жидкое состояние, так как металл в этом состоянии имеет меньший запас свободной энергии. Ниже температуры Ts меньшим запасом свободной энергии обладает металл в твердом состоянии. При температуре величины свободных энергий твердого и жидкого состояний равны. Это означает, что металл может находиться в обоих состояниях бесконечно долго, так как переход из одного состояния в другое не будет сопровождаться уменьшением свободной энергии. Температура Ts получила название теоретической температуры кристаллизации.
Для начала кристаллизации необходимо, чтобы свободная энергия металла в твердом состоянии стала меньше свободной энергии жидкого состояния. Это становится возможным при охлаждении жидкости ниже Ts. Температура, при которой фактически начинается процесс кристаллизации, называется фактической температурой кристаллизации (Тк). Охлаждение жидкого металла ниже теоретической температуры кристаллизации называется переохлаждение, а разность между теоретической и фактической температурой кристаллизации — степенью переохлаждения (ΔТ):
ΔТ = Тs - Тk
Степень переохлаждения зависит от скорости охлаждения жидкого металла. С увеличением скорости охлаждения понижается фактическая температура кристаллизации и, следовательно, возрастает степень переохлаждения.
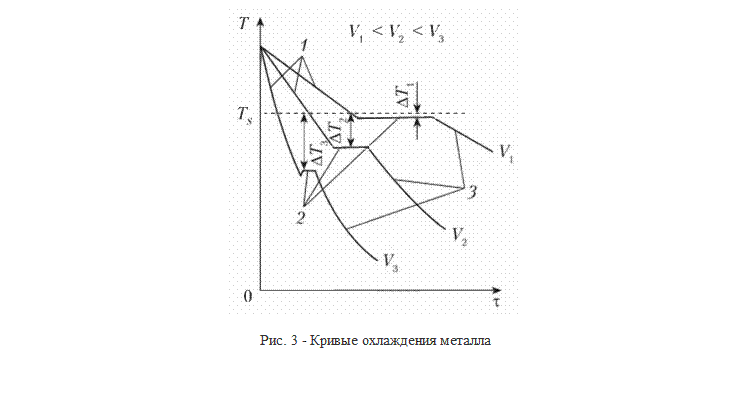
Процесс кристаллизации можно описать с помощью кривых охлаждения, построенных в координатах «температура — время» (рис. 3). Охлаждение в жидком состоянии сопровождается плавным понижением температуры (участок 1 кривой охлаждения), при достижении температуры кристаллизации на кривой охлаждения появляется горизонтальная площадка (участок 2 кривой охлаждения), т.е. охлаждение (понижение температуры) останавливается. Это вызвано тем, что отвод тепла компенсируется выделяющейся в процессе кристаллизации скрытой теплотой кристаллизации. После полного перехода металла из жидкого состояния в твердое температура вновь начинает плавно снижаться (участок 3 кривой охлаждения). Увеличение скорости охлаждения от V1 до V3 приводит к увеличению степени переохлаждения (рис. 3).
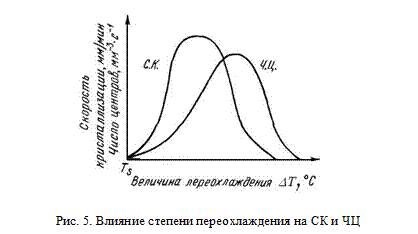
 Кристаллизация начинается с образования в жидком металле центров кристаллизации и продолжается за счет роста их числа и размеров (рис. 4). Процесс кристаллизации можно охарактеризовать двумя параметрами: числом центров кристаллизации (ЧЦ), образующихся в единицу времени в единице объема (1 см3/с), и скоростью роста кристаллов (СК) [мм /с]. Эти параметры зависят от степени переохлаждения, а следовательно, от скорости охлаждения при кристаллизации металла. В соответствии с законом Таммана для каждой степени переохлаждения указанные параметры могут иметь только одно значение (рис. 5).
Кристаллизация начинается с образования в жидком металле центров кристаллизации и продолжается за счет роста их числа и размеров (рис. 4). Процесс кристаллизации можно охарактеризовать двумя параметрами: числом центров кристаллизации (ЧЦ), образующихся в единицу времени в единице объема (1 см3/с), и скоростью роста кристаллов (СК) [мм /с]. Эти параметры зависят от степени переохлаждения, а следовательно, от скорости охлаждения при кристаллизации металла. В соответствии с законом Таммана для каждой степени переохлаждения указанные параметры могут иметь только одно значение (рис. 5).
 При теоретической температуре кристаллизации (Ts) значения ЧЦ и СК равны 0 и кристаллизация происходить не может. При повышении степени переохлаждения значения ЧЦ и СК возрастают, процесс кристаллизации идет быстро. Это объясняется тем, что при высоких температурах, близких к Тs подвижность атомов велика. При определенных степенях переохлаждения значения ЧЦ и СК достигают максимума, после чего снижаются вследствие уменьшения подвижности атомов при низких температурах.
При теоретической температуре кристаллизации (Ts) значения ЧЦ и СК равны 0 и кристаллизация происходить не может. При повышении степени переохлаждения значения ЧЦ и СК возрастают, процесс кристаллизации идет быстро. Это объясняется тем, что при высоких температурах, близких к Тs подвижность атомов велика. При определенных степенях переохлаждения значения ЧЦ и СК достигают максимума, после чего снижаются вследствие уменьшения подвижности атомов при низких температурах.
Размер образовавшихся в процессе кристаллизации зерен зависит от соотношения величин ЧЦ и СК, т.е. определяется степенью переохлаждения (скоростью охлаждения
металла в процессе кристаллизации). При малых степенях переохлаждения (низкой скорости охлаждения металла) образуется малое число центров кристаллизации, которые
растут с большой скорости. В этом случае структура металла после окончания кристаллизации будет крупнозернистой. При больших степенях переохлаждения, напротив, ЧЦ велико, а СК мала, поэтому структура металла получается мелкозернистой.
Если степень переохлаждения настолько велика, что значения ЧЦ и СК близки к пулю, кристаллизации не происходит. При этом образуется твердое тело, имеющее не кристаллическое строение с «правильным» расположением атомов, а аморфное — с хаотическим расположением атомов — «твердая жидкость».
Аморфное состояние характерно для неметаллических материалов (стекла, полимеры). Для получения аморфного состояния у металлических материалов требуется очень большая скорость охлаждения 106... 107 °С/с.
1.2. Метод термического анализа. Известно, что любое изменение состояния металлов и сплавов (фазовое, внутрифазовое или структурные превращения) вызывает изменение энтальпии, а потому должно сопровождаться тепловым эффектом - выделением или поглощением тепла. Таким образом, если при нагреве или охлаждении удается зафиксировать тепловой эффект, о котором можно судить и по изменению температуры металла, то можно выявить вид превращения и определить условия, способствующие или тормозящие превращение.
В практике металловедения наибольшее применение получил термический анализ, экспериментальная техника проведения которого является менее сложной. В случае термического анализа изменение энтальпии характеризуется изменением температуры, обычно фиксируемой в функции времени нагрева или охлаждения металла.
При термическом анализе автоматически записывается или строится по экспериментальным данным графическая зависимость — изменение температуры во времени в процессе нагрева (или охлаждения) с постоянной скоростью. Появление теплового эффекта вызывает при соответствующей температуре появление различного вида аномалии (ступеней, перегибов), поэтому он может быть зарегистрирован, а тем самым выявлено соответствующее превращение.
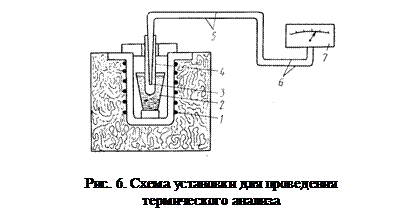
На рис. 6. показана схема установки для определения критических точек металлов и сплавов методом термического анализа. Схема установки для определения критических точек. Установка состоит из электропечи 1, в которую помещен тигель 2 с исследуемым металлом или сплавом, термопары 3, термостата 4, соединительных проводов 5 и милливольтметра 6. Температура сплава измеряется с помощью термоэлектрического пирометра, состоящего из термопары и милливольтметра. «Горячий» спай термопары, защищенный металлическим или фарфоровым чехлом, погружают в изучаемый расплав, а «холодный» спай - в термостат с постоянной температурой (0° С или 20 ° С). В этом случае показания прибора будут пропорциональны температуре «горячего» спая. Для получения более точной кривой охлаждения применяют автоматическую регистрацию с записью данных на компьютере.
1.3. Влияние химического состава сплава на термограмму кристаллизации. Использование различных схем термического анализа в сочетании с высокочувствительной измерительной аппаратурой позволяет достаточно надежно определять температуры превращений при изменении агрегатного состояния (например, при плавлении или затвердевании), при полиморфном превращении, эвтектоидном и других превращениях. Построение линий ликвидуса — солидуса на диаграммах состояния. Плавление и затвердевание относятся к числу фазовых превращений 1 рода и поэтому сопровождаются резким изменением энтальпии и, соответственно, значительными тепловыми эффектами. Так, теплота кристаллизации алюминия 394 кДж/кг; меди 180 кДж/кг, никеля 306 кДж/кг, железа 272 кДж/кг.
При нагревании или охлаждении тела в условиях равномерного подвода или отвода тепла количество тепла, сообщенного телу или отведенного от него, пропорционально времени. Поэтому информацию о тепловом эффекте и о вызвавшем его превращении дают зависимости температура—время. Хотя величину указанного эффекта при данной температуре непосредственно характеризует зависимость энтальпия—температура, однако ее установление в эксперименте затруднительно.
На практике строят кривые нагрева охлаждения (термограммы). По этим термограммам можно судить о температуре и характере превращений и строить линии ликвидуса и солидуса. На рис.6 приведены примеры кривых охлаждения для соответствующих сплавов системы «свинец-сурьма», составы которых указаны на диаграмме состояния.
Если жидкий металл или сплав допускает значительное переохлаждение (сплавы эвтектического состава или чистые металлы), то в начальной стадии кристаллизации скрытая теплота этого превращения выделяется очень бурно, поэтому металл быстро нагревается до равновесной температуры затвердевания, при которой и происходит дальнейший процесс кристаллизации. Если затвердевание происходит в интервале температур, например у твёрдых растворов, доэвтектических или заэвтектических сплавов, кривые охлаждения на стадии полного затвердевания имеют лишь незначительный изотермический эффект.
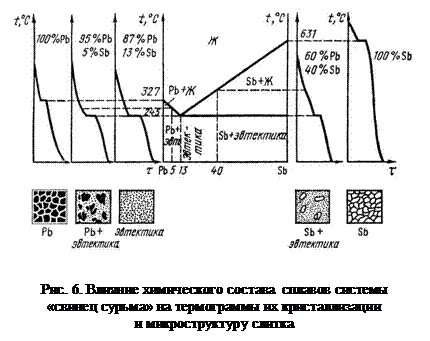
Чтобы этим кривым можно было надёжно строить диаграммы состояния необходимо обеспечить равномерность нагрева и охлаждения, чтобы на этих кривых не появились ложные перегибы, которые можно принять за температуры в действительности отсутствующих превращений.
Задание
1. Изучить диаграмму фазовых превращений исследуемых сплавов и методику проведения термического анализа.
2. Получить у преподавателя тигли со сплавами
3. Собрать автоматизированную установку для проведения термического анализа
4. Провести термический анализ сплавов.
5. Для каждого по кривой охлаждения определить температурные точки начала и конца кристаллизации.
6. Сравнить полученные результаты с данными диаграммы состояния.
Приборы и материалы
1. Тигли со сплавами различного химического состава.
2. Образцы данных сплавов для микроанализа
3. Электропеч
4. Термопара
5. Гальванометр
6. Секундомер
7. Цифровой вольтметр, подключенный к ПК
8. Диаграмма фазового равновесия исследуемых сплавов.
9. Градуировочный график термопары
 2017-12-14
2017-12-14 2467
2467