Как правило, жидкости, состоящие из больших молекул, будут иметь более высокую вязкость. Это особенно хорошо проявляется на примере длинных цепочечных веществ, которые являются полимерами или более тяжелыми углеводородными соединениями. Такие молекулы, как правило, перекрывают друг с друга, препятствуя движению через них.
Другим важным фактором является то, как молекулы взаимодействуют друг с другом. Полярные соединения могут образовывать водородные связи, которые удерживают отдельные молекулы вместе, увеличивая общее сопротивление потоку или движению. Хотя молекула воды и является полярной, она имеет низкую вязкость в связи с тем, что ее молекулы достаточно малы. Наиболее вязкие жидкости, как правило, те, которые имеют растянутые молекулы или сильную полярность. Примерами могут служить глицерин и пропиленгликоль.
Температура оказывает большое влияние на вязкость. Измерения свойств жидкостей всегда даются в зависимости от температуры. В жидкостях вязкость уменьшается с ростом температуры. Это можно видеть при нагревании сиропа или меда. Так происходит потому, что молекулы движутся быстрее и, следовательно, меньше времени контактируют друг с другом. Вязкость газов, напротив, увеличивается с ростом температуры. Это происходит потому, что молекулы движутся быстрее и происходит больше столкновений между ними. Таким образом увеличивается плотность потока.
31. Поверхность макромолекулы может иметь собственный заряд, возникающий благодаря расположенным на ней анионным и катионным группам.
Полиэлектролиты это полимеры, в макромолекулах которых содержатся ионогенные группы.
Величина и знак заряда белков, находящихся в растворе, зависит от рН среды. Это обстоятельство обусловлено неодинаковым числом ионогенных групп – СООН и – NH2. Меняя рН среды, можно изменять ионизирующую способность макромолекул белков. Константы диссоциации кислотных и основных групп белков не совпадают. По этой причине число диссоциированных основных и кислотных групп макромолекул белка может быть одним и тем же только при определѐнном значении рН среды. Такое состояние соответствует изоэлектрической точке (ИЭТ), т.е. значению рН среды, при котором число ионизированных основных групп равно числу ионизированных кислотных групп.
Изоэлектрическим состоянием белка называется состояние белковой молекулы, при котором её положительные и отрицательные заряды взаимно скомпенсированы.
Условно молекулу белка в изоэлектрическом состоянии можно изобразить так:
+ NH3 –R – COO ‾
Факторы, влияющие на величину и знак заряда белковой молекулы
1. Влияние аминокислотного состава белковой молекулы на ее заряд (при условии нейтральной среды, рН=7):
– если в белковой молекуле преобладают кислые аминокислоты(аспарагиновая и глутаминовая кислоты), то суммарный заряд белковой молекулы будет отрицательным (в нейтральной среде);
– если в белковой молекуле преобладают основные аминокислоты(лизин, аргинин, гистидин), то суммарный заряд белковой молекулы будет положительным (в нейтральной среде).
Например, молекула альбумина(анионогенный белок) содержит в полипептидной цепи много дикарбоновых аминокислот и, следовательно, имеет отрицательный заряд. В крови, которая имеет рН 7,4, отрицательный заряд альбумина равен 18. Другой пример –гистоны, входящие в состав хроматина ядра клетки, содержат много аргинина и лизина, следовательно, гистоны – это катионогенные белки.
2.Влияние рН среды на заряд белковой молекулы
Суммарный заряд белковой молекулы зависит от рН среды (в кислой среде заряд положительный, а в щелочной – отрицательный).
– если среда щелочная, рН>7
Высокая концентрация гидроксильных ионов (ОН–) подавляет ионизацию слабой аминогруппы и белки приобретаютотрицательный заряд:
– если среда кислая, рН<7
Высокая концентрация водородных ионов подавляет диссоциацию слабой карбоксильной группы аминокислот, и белки приобретают положительный заряд:
32. В живых тканях всегда наряду с растворами белков и их солей, присутствуют также ионы обычных электролитов (NaCI, KCI,CaСI2,Na2HPO4,NaHCO3).
Присутствие в организме солей белков, отделенных клеточной мембраной от растворов электролитов, приводит к перераспределению электролитов и соответственно влияет на осмотическое давление по обе стороны мембраны. Перераспределение электролитов подчиняется уравнению мембранного равновесия, выведенного Доннаном.
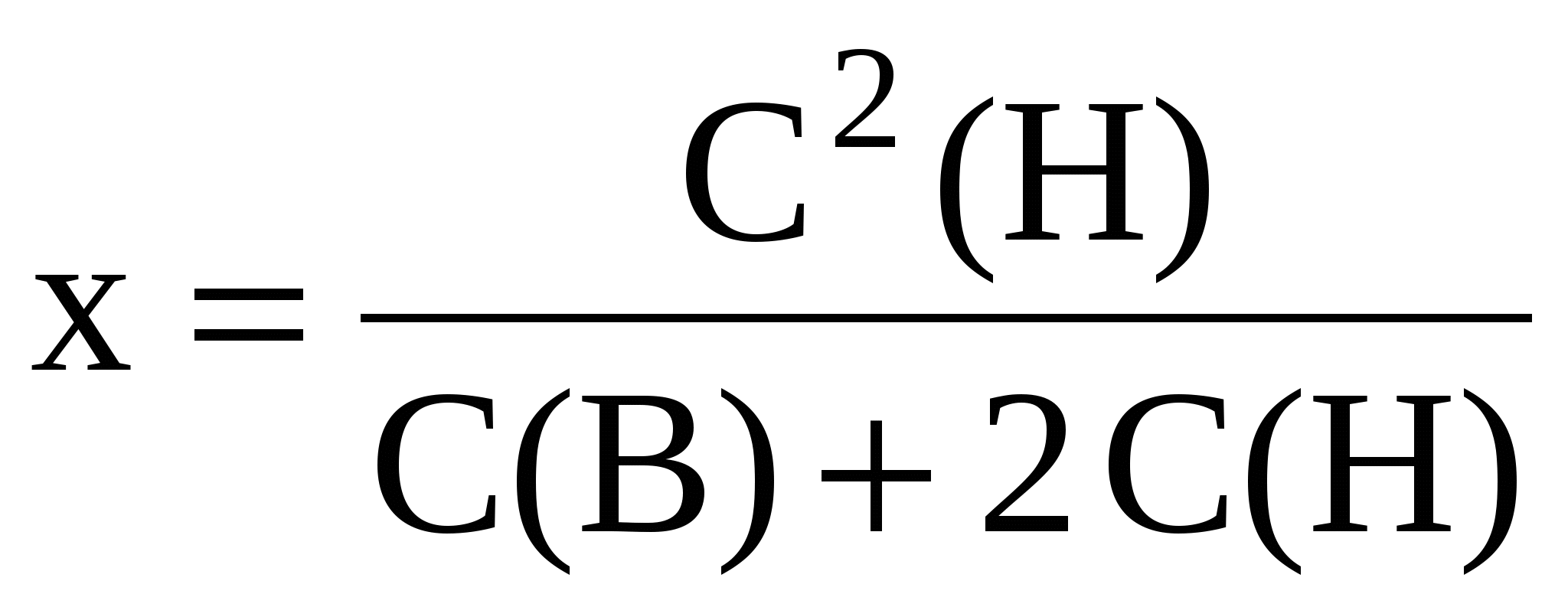
где: х – количество ионов, прошедших через мембрану внутрь клетки; С(Н) – количество ионов электролита снаружи мембраны; С(В) – количество ионов электролита внутри клетки.
В присутствии полиэлектролитов всегда наблюдается явление перераспределения ионов через мембрану (эффект Доннана), что будет сказываться на осмотическом давлении, величине биопотенциалов. Поэтому, в живом организме эффект Доннана является одной из причин сложных процессов изменения осмотического давления, изменения мембранного потенциала, ввиду перераспределения электролитов в присутствии полиэлектролитов - белков.
33. Застудневание (желатинирование) – процесс фазового перехода из жидкого состояния в твѐрдое состояние. Образование студня происходит в результате взаимодействия между макромолекулами ВМС. Макромолекулы неоднородны и имеют лиофильные (по отношению к воде – гидрофильные) и лиофобные (гидрофобные) участки. У гидрофильных групп макромолекул (-NH2, -COH, =NH, -OН, -COOH) образуются гидратные слои. Эти слои экранируют отдельные участки макромолекул. Гидрофобные группы (например, -СН2 – боковых звеньев белков) неспособны формировать подобные слои. Наличие свободных, не защищѐнных сольватной (гидратной) оболочкой участков макромолекул при определѐнных условиях, в частности при росте концентрации ВМС, приводит к возникновению взаимодействия между этими участками; в результате образуется структура (каркас, сетка) из макромолекул ВМС, а раствор ВМС переходит в студень.
 2017-12-14
2017-12-14 4844
4844
