При добавлении к золям некоторых высокомолекулярных веществ устойчивость золей к действию электролитов значительно повышается, что выражается в повышении порога коагуляции. Такое явление получило название коллоидной защиты. Защищенный золь поддается концентрированию и даже выпариванию досуха и становится обратимым (т.е. термодинамически устойчивым), он как бы приобретает свойства раствора высокомолекулярного вещества.
Механизм защитного действия зависит от образования адсорбционного слоя введенного вещества вместе с его гидратными оболочками на поверхности частиц гидрофобного золя. Защитными веществами в водной среде могут служить белки, углеводы, пектины. Различные высокомолекулярные вещества защищают слои неодинаково. Мерой защитного действия высокомолекулярных соединений является так называемое «золотое число» - то минимальное количество миллиграммов сухого высокомолекулярного соединения, которое необходимо добавить к 10 мл стандартного (красного) золя золота для того, чтобы предотвратить его коагуляцию (посинение) при введении в систему 1 мл 10%-го раствора хлорида натрия.
Явление защиты играет большую роль в жизни организма. Так, белки крови защищают жир, холестерин, малорастворимые соли кальция и мочевой кислоты от коагуляции и выделения на стенках сосудов. При понижении защитной функции белков возникают заболевания: атеросклероз, кальциноз, подагра, образование камней в почках, печени ит.п.
Часть 3
Растворы ВМС
27. Высокомолекулярные соединения (ВМС) - химические ве-
щества с большой молекулярной массой, которые состоят из большого числа повторяющихся фрагментов. Высокомолекулярные соединения часто называют полимерами.
По происхождению полимеры в первую очередь делят на природные и химические. Природные полимеры представлены растительными, животными и минеральными соединениями. Растительные и животные ВМС в основном имеют природу органических веществ. Характерными представителями таких соединений являются природные белки, натуральный каучук, шелк, шерсть и др. Химические полимеры делят на искусственные (получают переработкой природных полимеров) и синтетические (синтезируют из низкомолекулярных веществ - мономеров).
К числу искусственных ВМС относятся: нитроцеллюлоза (используемая для получения целлулоида), ксантогенат целлюлозы (вискоза), ацетат целлюлозы и др.
К синтетическим полимерам - наиболее важному классу ВМС относятся полиэтилен, поливинилхлорид, полистиролы, фенолформальдегидные смолы, полиамиды и др.
Линейные полимеры построены из длинных одномерных элементов структуры – отдельных макромолекул или молекулярных блоков. К ним относятся натуральный каучук, желатин, целлюлоза.
Разветвленные полимеры состоят из цепей с боковыми ответвлениями. Это крахмал (гликоген), амилопектин, дивиниловый каучук и другие.
Пространственные полимеры представляют собой трехмерную сетку, которая образуется при соединении отрезков цепей химическими связями (например, фенолформальдегидные смолы). Пространственные полимеры, цепи которых сшиты короткими мостичными связями, например, атомами ОилиS, называются сшитыми (резина, эбонит, некоторые акриловые полимеры).
28. Высокомолекулярные вещества (или полимеры) растворяются в различных низкомолекулярных жидкостях, образуя устойчивые равновесные системы с молекулярной дисперсностью компонентов. Таким образом, растворы полимеров являются гомогенными системами, истинными растворами. Являясь истинными растворами, растворы ВМС всѐ же отличаются от растворов низкомолекулярных веществ, что связано с огромными размерами макромолекул. Однако, несмотря на огромные размеры молекул ВМС в растворах отсутствует граница раздела фаз, так как в одном направлении макромолекула имеет достаточно большую длину, а толщина макромолекулы имеет молекулярные размеры.
Растворение ВМС осуществляется с образованием менее упорядоченной системы из более упорядоченной и, значит, этот процесс протекает с увеличением энтропии (ΔS > 0). Растворение ВМС – процесс самопроизвольный, следовательно, при растворении полимеров уменьшается свободная энергия: Δ G = Δ H - T Δ S < 0.
Растворы ВМС, подобно растворам низкомолекулярных соединений, могут быть и молекулярными, и ионными, причѐм в последнем случае природа зарядов связана с наличием функциональных групп.
1. Растворы ВМС представляют собой гомогенные системы, это истинные растворы, где взвешенные частицы являются макромолекулами гигантских
размеров.
2. Растворение ВМС – самопроизвольный процесс, осуществляемый с
уменьшением свободной энергии: ∆G = ∆H - T∆S ‹ 0.
Изменение энтальпии (знак ∆Н) при растворении может быть положительным (эндотермическая реакция), отрицательным (экзотермическая реакция) или равным нулю.
Растворы ВМС термодинамически устойчивые системы, способные существовать без стабилизаторов неограниченное время.
3. В отличие от лиофобных коллоидных систем растворы ВМС являются равновеснымим системами.
4. Растворы ВМС, подобно растворам низкомолекулярных соединений, могут быть и молекулярными, и ионными, причѐм в последнем случае природа зарядов связана с наличием функциональных групп.
5. Являясь истинными растворами, растворы ВМС всѐ же отличаются от растворов низкомолекулярных веществ. Огромные размеры макромолекул являются ответственными за большинство физических свойств растворов ВМС, которые отличаются от свойств низкомолекулярных соединений. На поведение растворов ВМС сильное влияние оказывают форма и отдельные фрагменты строения макромолекул.
29. Растворение высокомолекулярных соединений представляет собой сложный процесс, отличающийся от растворения низкомолекулярных веществ. Так, при растворении последних происходит взаимное смешение растворителя и растворяемого вещества, т.к. они имеют близкие по размерам и по скорости диффузии молекулы.
При растворении полимеров вначале происходит процесс их набухания, т.е. одностороннее проникновение небольших и подвижных молекул растворителя в полимер. Набухание сопровождается увеличением массы и размеров твердого образца полимера и является начальным этапом растворения высокомолекулярных веществ.
Количественной мерой набухания является степень набухания α:

или

где m0 и V0 – масса и объѐм сухого полимера; m и V – масса и объѐм набухшего полимера.
Факторы влияющие на степень набухания
1. Природа ВМС и растворителя (неполярные полимеры хорошо набухают и растворяются в неполярных растворителях, полярные – в полярных).
2. Время жизни ВМС: чем старше полимер, тем хуже он набухает.
3. Температура: интенсифицирует процесс набухания.
4. рН среды. Существенное влияние оказывает на набухание полиэлектролитов, т.е. ВМС, способных в растворе диссоциировать с образованием высокомолекулярного иона.
5. Добавка электролита. Если к раствору ВМС добавить электролит, можно наблюдать образование хлопьев. Этот процесс называется высаливаниемВМС. Механизм: электролит диссоциирует на ионы, ионы гидратируются, при этом оттягивается вода от ВМС. При высокой концентрации электролита гидратная оболочка у ВМС становится тонкой, раствор по количеству полимера становится пересыщенным и ВМС выпадает в осадок.
30. Вязкость жидкостей можно для простоты определить как сопротивление жидкости передвижению одного еѐ слоя относительно другого при сдвиге, растяжении и других видах деформации.
Истинные растворы НМС являются ньютоновскими жидкостями, для них вязкость описывается уравнением Ньютона:
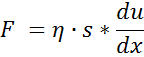
где F – сила, необходимая для возникновения перемещения двух соседних слоѐв раствора; du / dx –градиент скорости; ε – коэффициент вязкости. Вязкость, вычисленная по уравнению Ньютона, не зависит от напряжения сдвига, определяемой действующей силой, типом вискозиметра и т.д. Величина вязкости при данной температуре для НМС является инвариантной (неменяющейся) характеристикой.
Высокая вязкость растворов полимеров объясняется большими размерами молекул (макромолекул) и их цепеобразным строением.
Такие молекулы оказывают большое сопротивление перемещению молекул растворителя. С увеличением концентрации полимера происходит быстрый рост вязкости.
Растворы ВМС являются неньютоновскими жидкостями, так как они не обладают постоянной вязкостью. У растворов ВМС наблюдается аномалия вязкости.
В растворах полимеров происходит образование пространственных структур, образуемых сцеплением макромолекул, что и вызывает резкое повышение вязкости. При течении растворов полимеров работа затрачивается не только на преодоление истинной (ньютоновской) вязкости, но и на разрушение структуры раствора.
Вязкость растворов ВМС в значительной степени зависит от температуры и свойств растворителя. Растворители способны влиять на конформационную форму макромолекул и за счѐт этого изменять вязкость одного и того полимера в разных растворителях. Таким образом, вязкость растворов ВМС определяется природой полимера и природой растворителя.
Характеристическую вязкость определяют на основании вискозиметрических измерений, используя значение относительной, удельной и приведенной вязкостей.
Характеристическая вязкость для данной пары веществ является величиной условной, но постоянной, она не зависит от концентрации растворителя и состояния макромолекул, кроме того, она связана с молекулярной массой макромолекул.
Величину [ 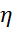 ] называют характеристической вязкостью или предельным числом вязкости.
] называют характеристической вязкостью или предельным числом вязкости.
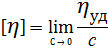
Характеристическую вязкость определяют на основании вискозиметрических измерений, используя значения относительной, удельной и приведѐнной вязкости в качестве вспомогательных величин.
Характеристическая вязкость для данной пары веществ (растворитель – полимер) является условной, но постоянной величиной, которая не зависит от концентрации растворителя и конформационных состояний макромолекул.
Уравнение Марка-Куна-Хаувинка:
[ 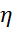 ] = KMα
] = KMα
где К – постоянная величина, экспериментально определяемая для данных макромолекул и растворителя. Показатель степени α зависит от формы макромолекул. Для белков компактной структуры – глобулярных белков – он составляет около 0,5. Для молекул, находящихся в конформации беспорядочного клубка, показатель степени возрастает до 2. Молекулярная масса, определяемая по уравнению Марка-Куна-Хаувинка, называется средневязкостной молекулярной массой Мε.
 2017-12-14
2017-12-14 9905
9905








