План лекции
1. Азот. Положение в ПС. Степени окисления. Нахождение в природе. Физические и химические свойства.
2. Водородные соединения азота (аммиак, гидразин, гидроксиламин, азотистоводородная кислота).
3. Кислородные соединения азота (оксиды азота, азотноватистая, азотистая и азотная кислоты).
4. Фосфор. Физические и химические свойства. Водородные и кислородные соединения.
5. Азотные и фосфорные удобрения.
14.1 Азот. Положение в ПС. Степени окисления. Нахождение в природе. Физические и химические свойства
Азот – это p-элемент 5 группы ПС. На валентном слое у него 5 электронов (2s2 2p3). Степени окисления -3,-2,-1, 0, +1, +2, +3, +4, +5. Это типичный неметалл.
Общее содержание азота земной коры насчитывается около 0,03%. Наибольшая его часть сосредоточена в атмосфере, основную массу которой (75,6 вес.%) и составляет свободный азот (N2). Сложные органические производные азота входят в состав всех живых организмов. В результате отмирания этих живых организмов и тления их останков образуются более простые азотные соединения, которые при благоприятных условиях (главным образом – отсутствие влаги) могут накапливаться в земной коре.
При обычных условиях азот представляет собой бесцветный не имеющий запаха газ. Бесцветен он также в жидком и твёрдом состоянии.
Свободный азот химически весьма инертен. Между атомами в молекуле азота тройная связь (энергия связи 940 кдж/моль). При обычных условиях он практически не реагирует ни с металлами (кроме Li и Mg), ни с неметаллами. Нагревание увеличивает его химическую активность главным образом по отношению к металлам, с некоторыми из которых он соединяется, образуя нитриды. При температуре 30000 С он реагирует с кислородом воздуха.
14.2 Водородные соединения азота (аммиак, гидразин и гидроксиламин)
Формулы водородных соединений, соответственно:
NH3, N2H4, NH2OH, HN3.
Аммиак представляет собой бесцветный газ с характерным резким запахом (“нашатырного спирта”). Растворимость его в воде больше, чем всех других газов: один объём воды поглощает при 0ºС около 1200, а при 20º С – около 700 объёмов NH3.
Гидразин N2H4 представляет собой бесцветную жидкость, дымящую на воздухе и легко смешивающуюся с водой, а гидроксиламин NH2OH представляет собой бесцветные кристаллы, хорошо растворимые в воде.
Для химической характеристики аммиака, гидразина и гидроксиламина основное значение имеют реакции трёх типов: присоединения, замещения водорода и окисления.
При растворении в воде часть молекул аммиака химически реагирует с водой, образуя слабое основание (Kd = 1,8×10-5).
NH3 + H2O ↔ NH4OH ↔ NH4+ + OH¯
Гидразин и гидроксиламин тоже частично реагируют с водой. Растворы этих веществ являются более слабыми основаниями по сравнению с аммиаком (Kd = 8,5×10-7 и Kd = 2∙10-8).
Азотистоводородная кислота HN3 представляет собой бесцветную, обладающую острым запахом жидкость, ее ядовитые, разъедающие слизистые оболочки, пары при соприкосновении с нагретыми предметами с большой силой взрываются.
В водных растворах кислота устойчива. Это слабая (несколько слабее уксусной) кислота (K = 1,2∙10-5), диссоциирующая по схеме:
HN3 ↔ H+ + N3-
Соли называются азидами, врывчаты (детонаторы).
14.3 Кислородные соединения азота (оксиды азота, азотная и азотистая кислоты)
Азот образует оксиды: N2O, NO, N2O3, NO2, N2O5. Все оксиды газообразные вещества при обычных условиях, кроме N2O5 (бесцветное кристаллическое вещество).
Первые два несолеобразующие, а остальные являются кислотными.
N2O3 - ангидрид азотистой кислоты (HNO2).
NO2 - ангидрид азотистой (HNO2). и азотной (HNO3) кислот.
N2O5 – ангидрид азотной кислоты.
Азот образует несколько кислот: H2N2O2 – азотноватистая, HNO2 – азотистая, HNO3 – азотная.
Азотноватистая кислота H2N2O2 кристаллическое вещество белого цвета, взрывчатое, легко растворимое в воде. В водном растворе это слабая, умеренно устойчивая, двухосновная кислота (K1d = 9×10-8 и K2d = 10-11).
Азотистая кислота HNO2 слабая и неустойчивая одноосновная кислота (Kd = 5×10-4), существующая в водных растворах. Соли нитриты устойчивы. Азотистая кислота и ее соли проявляют окислительно-восстановительную двойственность, поскольку содержат азот в промежуточной степени окисления (+3).
Чистая азотная кислота HNO3 —бесцветная жидкость плотностью 1,51 г/см 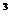 при – 42°С застывающая в прозрачную кристаллическую массу
при – 42°С застывающая в прозрачную кристаллическую массу
Азотная кислота принадлежит к числу наиболее сильных кислот, в разбавленных водных растворах она полностью распадается на ионы:
HNO3 → Н+  + NO3¯.
+ NO3¯.
Азотная кислота является сильным окислителем. Она окисляет металлы до солей, а неметаллы до высших кислородных кислот. При этом она восстанавливается в концентрированных растворах до диоксида азота, а в разбавленных в продуктах ее восстановления в зависимости от активности металла могут быть N2, NO, N2O, N2O3, NH4NO3.
Азотная кислота не действует на золото, платину, родий и иридий. Некоторые металлы пассивируются (покрываются защитной пленкой) в концентрированной азотной кислоте. Это алюминий, железо и хром.
Соли азотной кислоты – нитраты. Хорошо растворяются в воде, устойчивы при обычных условиях. При нагревании распадаются с выделением кислорода.
14.4 Фосфор. Физические и химические свойства. Водородные и кислородные соединения
Для твёрдого фосфора известно несколько аллотропических модификаций, из которых практически приходится встречаться только с двумя: белой и красной.
При хранении белый фосфор постепенно (очень медленно) переходит в более устойчивую красную форму. Переход сопровождается выделением тепла (теплота перехода):
P белый = P красный + 4 ккал
Химическая активность фосфора значительно выше, чем у азота. Так, он легко соединяется с кислородом, галоидами, серой и многими металлами. В последнем случае образуется аналогичные нитридам фосфиды (Mg3P2, Ca3P2 и др.).
Водородные соединения фосфора – это фосфин (PH3) и дифосфин (P2H4).
Дифосфин (P2H4) – жидкий фофористый водород, самовоспламеняющийся на воздухе (блуждающие огни на кладбище объясняются образованием этого вещества при тлении останков).
Фосфористый водород (“фосфин”) – PH3 представляет собой бесцветный газ с неприятным запахом (“гнилой рыбы”). Фосфин является очень сильным восстановителем (фосфор имеет степень окисления –3) и весьма ядовит. В противоположность аммиаку реакции присоединения для фосфина мало характерны. Соли фосфония известны лишь для немногих сильных кислот и весьма нестойки, а с водой фосфин химически не взаимодействует (хотя довольно хорошо растворим в ней).
Кислородные соединения фосфора - оксиды P2O3 и P2O5,существующие в виде димеров (P2O3)2 и (P2O5)2, а также кислоты: H3PO2 – фосфорноватистая, H3PO3 – фосфористая, H3PO4 – фосфорная.
Горение фосфора при недостатке воздуха или медленное окисление даёт главным образом фосфористый ангидрид (P2O3). Последний представляет собой белую (похожую на воск) кристаллическую массу. При нагревании на воздухе он переходит в P2O5 (белую снегообразную массу). Взаимодействуя с холодной водой, P2O3 медленно образует фосфористую кислоту:
P2O3 + 3H2O = 2H3PO3
P2O5 - высший оксид – фосфорный ангидрид получается при сгорании фосфора в избытке кислорода (или воздуха). Фосфорный ангидрид (P2O5) чрезвычайно энергично притягивает влагу и поэтому часто применяется в качестве осушителя газов.
Взаимодействие P2O5 с водой в зависимости от числа присоединённых молекул H2O приводит к образованию следующих гидратных форм:
P2O5 + H2O = 2HPO3 (метафосфорная)
P2O5 + 2H2O = H4P2O7 (пирофосфорная кислота)
P2O5 + 3H2O = 2H3PO4 (ортофосфорная кислота)
H3PO2 (фосфорноватистая кислота) - это бесцветное кристаллическое вещество. В водном растворе сильная одноосновная кислота. Она самая сильная среди кислот фоссфора. Сама кислота и ее соли (гипофосфиты) являются восстановителями.
Свободная фосфористая кислота (H3PO3) представляет собой бесцветные кристаллы, расплывающиеся на воздухе и легкорастворимые в воде. Она является сильным (но в большинстве случаев медленно действующим) восстановителем. Несмотря на наличие в молекуле трёх водородов, H3PO3 функционирует только как двухосновная кислота средней силы. Соли её (фосфористокислые или фосфиты), как правило, бесцветны и плохо растворимы в воде. Из производных чаще встречающихся металлов хорошо растворимы лишь соли Na, K, Ca.
Наибольшее практическое значение из кислот пятивалентного фосфора имеет ортогидрат (H3PO4).
Фосфорная кислота представляет собой бесцветные, расплывающиеся на воздухе кристаллы. Продаётся она обычно в виде 85%-ного водного раствора, приблизительно отвечающего составу 2H3PO4 H2O и имеющего консистенцию густого сиропа. В отличии от многих других производных фосфора, H3PO4 неядовита. Окислительные свойства для неё вовсе не характерны.
Будучи трёхосновной кислотой средней силы, H3PO4 способна образовывать три ряда солей, например: кислые соли Na2HPO4 и Na2HPO4, а также среднюю соль - Na3PO4
NaH2PO4 - дигидрофосфат натрия (первичный фосфорнокислый натрий)
Na2HPO4 - гидрофосфат натрия (вторичный фосфорнокислый натрий)
Na3PO4 – фосфат натрия (третичный фосфорнокислый натрий).
14.5 Азотные и фосфорные удобрения.
Азот и фосфор – это макроэлементы, которые необходимы растительным и животным организмам в больших количествах. Азот входит в состав белка. Фосфор входит в состав костей. Органические производные фосфорной кислоты являются источниками энергии для эндотермических реакций клетки.
Азотные удобрения это соли азотной кислоты: KNO3 – калийная селитра, NaNO3 – натриевая селитра, NH4NO3 – аммонийная селитра, Ca(NO3)2 – норвежская селитра. Растворы аммиака в воде – жидкое азотное удобрение.
Фосфорные удобрения это соли фосфорной кислоты: Ca(H2PO4)2×2CaSO4 – простой суперфосфат, Ca(H2PO4)2 – двойной суперфосфат, CaHPO4 ×2H2O –преципитат. Макроудобрения вносятся в почву в больших количествах (в центнерах на гектар).
 2017-12-14
2017-12-14 4579
4579
