С 1 января 1963 г. введена Международная система единиц измерения (СИ), состоящая из шести основных единиц: метр (м) – длина, килограмм (кг) – масса, секунда (с) – время, ампер (А) – сила тока, кельвин (К) – термодинамическая температура, кандела (кд) – сила света. XIV Генеральная конференция по мерам и весам (1971г) утвердила в качестве седьмой основной единицы Международной системы моль (моль) – единицу количества вещества. Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицируемыми группами частиц. Моль вещества соответствует постоянной Авогадро NA=(6,022045 ± 0,000031) × 1023 моль-1 структурных элементов. При применении понятия «моль» следует указывать, какие структурные элементы имеются в виду, например моль атомов Н, моль молекул Н2, моль протонов, моль электронов и т.п. Так заряд моля электронов равен 6,022 × 1023 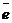 и отвечает количеству электричества, равному 1 фарадею (F). Масса моля атомов или масса моля молекул (мольная или молярная масса), выраженная в граммах (г/моль), есть грамм-атом данного элемента или соответственно грамм-молекула данного вещества в прежнем понимании.
и отвечает количеству электричества, равному 1 фарадею (F). Масса моля атомов или масса моля молекул (мольная или молярная масса), выраженная в граммах (г/моль), есть грамм-атом данного элемента или соответственно грамм-молекула данного вещества в прежнем понимании.
|
|
|
Пример 1. Выразите в молях: а) 6,02 × 1021молекул СО2; б)1,20 × 1024 атомов кислорода; в) 2,00 × 1023 молекул воды. Чему равна мольная (молярная) масса указанных веществ?
Решение
Моль – это количество вещества, в котором содержится число частиц любого определенного сорта, равное постоянной Авогадро (6,02 × 1023). Отсюда а) 6,02 × 1021, т.е. 0,01 моль. б) 1,20 × 1024, т.е. 2 моль. в) 2,00 × 1023, т.е. 1/3 моль.
Масса моля вещества выражается в кг/моль или г/моль. Молярная (мольная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а. е. м.).
Так как молекулярные массы СО2 и Н2О и атомная масса кислорода соответственно равны 44; 18 и 16 а. е. м., то их мольные (молярные) массы равны: а) 44 г/моль; б) 18 г/моль; в) 16 г/моль.
Пример 2. Определите число эквивалентности (z) и молярную массу эквивалента азота (М(1/z, N), серы (М(1/z, S) и хлора (М(1/z, Cl) в соединениях NH3, H2S, HCl.
Решение
Масса вещества и количество вещества – понятия неидентичные. Масса выражается в килограммах (граммах), а количество вещества – в молях.
Эквивалентом называют реальную или условную частицу вещества В, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или одному электрону в данной реакции окисления-восстановления. Эквивалент – условная частица вещества В, которая в z(В) раз меньше соответствующей формульной единицы. Число z(В) называется числом эквивалентности.
|
|
|
Масса 1 эквивалента вещества (элемента) называется его молярной массой эквивалента (М(1/z, В)). Таким образом, эквиваленты выражаются в молях, а молярные массы эквивалентов – в г/моль.
В данных соединениях с 1 моль атомов водорода соединяется 1/3 моль азота, 1/2 моль серы и 1 моль хлора. Отсюда z(N) = 3, z(S) = 1/2, z(Cl) = 1. Исходя из молярных масс этих элементов, определяем их молярные массы эквивалента: М(1/3, N) = 14/3 = 4,67 г/моль; М(1/2, S) = 32/2 = 16 г/моль; М(1/1, Cl) = 35,45/1 = 35,45 г/моль.
Пример 3. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 дм3 водорода (н.у.). Вычислите молярную массу эквивалента оксида и молярную массу эквивалента металла. Чему равна атомная масса металла?
Нормальные условия по Международной системе единиц (СИ): давление 1,013 × 105 Па (760 мм рт.ст. = 1 атм), температура 273 К или 00 С.
Решение
Согласно закону эквивалентов массы (объемы) реагирующих друг с другом веществ m(А) и m(В) пропорциональны их молярным массам эквивалентов (объемам):
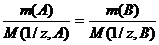 (1)
(1)
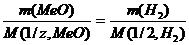 (2)
(2)
Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объемных единицах (см3, дм3, м3).
Объем, занимаемый при данных условиях молярной или молярной массой эквивалента газообразного вещества, называется молярным или, соответственно, эквивалентным объемом этого вещества. Молярный объем любого газа при н.у. равен 22,4 дм3. Отсюда эквивалентный объем водорода 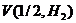 , молекула которого состоит из двух атомов, т.е. содержит два моля атомов водорода, равен 22,4: 2 = 11,2 дм3. В формуле (2) отношение
, молекула которого состоит из двух атомов, т.е. содержит два моля атомов водорода, равен 22,4: 2 = 11,2 дм3. В формуле (2) отношение 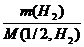 заменяем равным ему отношением
заменяем равным ему отношением 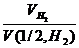 , где
, где 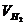 – объем водорода,
– объем водорода, 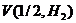 – эквивалентный объем водорода:
– эквивалентный объем водорода: 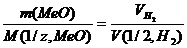 (3)
(3)
Из уравнения (3) находим молярную массу эквивалента оксида металла 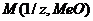 :
: 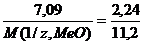 ;
; 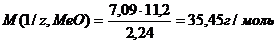
Согласно закона эквивалентов 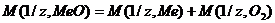 , отсюда
, отсюда 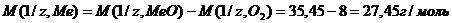 . Молярная масса металла определяется из соотношения М(1/z, Ме) = М(Ме)/В, где М(1/z, Ме) – молярная масса эквивалента металла, М(Ме) – молярная масса металла, В – стехиометрическая валентность элемента; М(Ме) = М(1/z, Ме) × В = 27,45 × 2 = 54,9 г/моль. Так как атомная масса в а.е.м. численно равна молярной массе, выражаемой в г/моль, то искомая масса металла 54,9 а.е.м.
. Молярная масса металла определяется из соотношения М(1/z, Ме) = М(Ме)/В, где М(1/z, Ме) – молярная масса эквивалента металла, М(Ме) – молярная масса металла, В – стехиометрическая валентность элемента; М(Ме) = М(1/z, Ме) × В = 27,45 × 2 = 54,9 г/моль. Так как атомная масса в а.е.м. численно равна молярной массе, выражаемой в г/моль, то искомая масса металла 54,9 а.е.м.
Пример 4. Сколько металла (г), молярная масса эквивалента которого 12,16 г/моль, взаимодействует с 310 см3 кислорода (н.у.)?
Решение
Так как молярная масса О2 (32 г/моль) при н.у. занимает объем 22,4 дм3, то объем эквивалентной массы кислорода (8 г/моль) будет
22,4: 4 = 5,6 дм3 = 5600см3. По закону эквивалентов
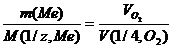 или
или 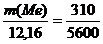
Откуда 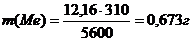 .
.
Пример 5. Вычислите числа эквивалентности и молярные массы эквивалентов H2SO4 и Al(OH)3 в реакциях, выраженных уравнениями:
H2SO4 + KOH = KHSO4 + H2O (1)
H2SO4 + Mg = MgSO4 + H2O (2)
Al(OH)3 + HCl = Al(OH)2Cl + H2O (3)
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O (4)
Решение
Молярная масса эквивалента сложного вещества, эквивалент и число эквивалентности элемента, может иметь различные значения и зависят от того, в какую реакцию обмена вступает это вещество. Молярная масса эквивалента кислоты (основания) равна молярной массе (М), деленной на число атомов водорода, замещенных в данной реакции на металл (на число вступающих в реакцию гидроксильных групп). Следовательно, число эквивалентности и молярная масса эквивалента H2SO4 в реакции (1) соответственно равны z(H2SO4) = 1, М(1/1, H2SO4) = 98/1 = 98 г/моль, а в реакции (2) z(H2SO4) = 2, М(1/2, H2SO4) = 98/2 = 49 г/моль. Число эквивалентности и молярная масса эквивалента Al(OH)3 в реакции (3) z(Al(OH)3) = 1, М(1/1, Al(OH)3) = 78/1 = 78 г/моль, а в реакции (4) z(Al(OH)3) = 3, М(1/3, Al(OH)3) = 78/3 = 26 г/моль.
Задачу можно решить и другим способом. Так как H2SO4 взаимодействует с одной молярной массой эквивалента КОН и двумя молярными массами эквивалента магния, то ее молярная масса эквивалента равна в реакции (1) М/1 г/моль и в реакции (2) М/2 г/моль. Al(OH)3 взаимодействует с одной молярной массой эквивалента HCl и тремя молярными массами эквивалента HNO3, поэтому его молярная масса эквивалента в реакции (3) равна М/1 г/моль, в реакции (4) М/3 г/моль.
|
|
|
Пример 6. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите молярную массу эквивалента металла (М(1/z, Ме).
Решение
При решении задачи следует иметь в виду: а) молярная масса эквивалента гидроксида равна сумме молярных масс эквивалентов металла и гидроксильной группы; б) молярная масса эквивалента соли равна сумме молярных масс эквивалентов металла и кислотного остатка. Вообще молярная масса эквивалента химического соединения равна сумме молярных масс эквивалентов составляющих его частей.
Учитывая сказанное, подставляем соответствующие данные в уравнение (1) примера 3:
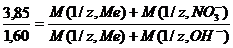 ;
; 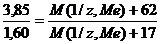
Получаем 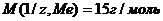
Пример 7. В какой массе Ca(OH)2 содержится столько же эквивалентов, сколько в 312 г Al(OH)3?
Решение
Молярная масса эквивалента равна М(1/3, Al(OH)3) = М(Al(OH)3)/3 = 78/3 = 26 г/моль. Следовательно, в 312 г Al(OH)3 содержится 312/26 = 12 эквивалентов. Молярная масса эквивалента Ca(OH)2 равна М(1/2, Са(OH)2) = М(Са(OH)2)/2 = 37 г/моль. Отсюда 12 эквивалентов составляют 37 г/моль × 12 моль = 444 г.
Пример 8. Вычислите абсолютную массу молекулы серной кислоты в граммах.
Решение
Моль любого вещества (см. пример 1) содержит постоянную Авогадро NA структурных единиц (в нашем примере молекул). Молярная масса H2SO4 равна 98,0 г/моль. Следовательно, масса одной молекулы 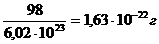 .
.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Определите число эквивалентности и молярную массу эквивалента фосфора, кислорода и брома в соединениях PH3, H2O, HBr.
2. В какой массе NaOH содержится столько же эквивалентов, сколько в 140 г КОН?
Ответ: 100г.
3. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите молярную массу эквивалента этого металла.
Ответ: 32,5 г/моль
4. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите молярную массу эквивалента этого металла.
Ответ: 9 г/моль.
5. Оксид трехвалентного элемента содержит 31,58 % кислорода. Вычислите молярную массу эквивалента, молярную и атомную массы этого элемента.
|
|
|
6. Чему равен при н.у. эквивалентный объем водорода? Вычислите молярную массу эквивалента металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 дм3 водорода (н. у.).
Ответ: 32,68 г/моль.
7. Выразите в молях: а) 6,02 × 1022 молекул C2H2; б) 1,80 × 1024 атомов азота; в) 3,01 × 1023 молекул NH3. Какова молярная масса указанных веществ?
8. Вычислите число эквивалентности и молярную массу эквивалента H3PO4 в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата.
9. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярные массы эквивалентов металла и его оксида. Чему равна молярная и атомная массы этого металла?
10. Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 дм3 кислорода (н.у.). Вычислите молярную массу эквивалента, молярную массу и атомную массу этого металла.
11. Из 3,31 г нитрата металла получается 2,78 г его хлорида. Вычислите молярную массу эквивалента этого металла.
Ответ: 103,6 г/моль.
12. Напишите уравнения реакций Fe(OH)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) хлорид дигидроксожелеза; б) дихлорид гидроксожелеза; в) трихлорид железа. Вычислите число эквивалентности и молярную массу эквивалента Fe(OH)3 в каждой из этих реакций.
13. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнения реакций этих веществ с КОН и определите их числа эквивалентности и молярные массы эквивалентов.
14. В каком количестве Cr(OH)3 содержится столько же эквивалентов, сколько в 174,96 г Mg(OH)2?
15. Избытком хлороводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) дихлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с HCl и определите их числа эквивалентности и молярные массы эквивалентов.
16. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите молярные массы эквивалентов металла и его оксида. Чему равна молярная и атомная массы металла?
17. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите молярную, атомную массы и молярную массу эквивалента металла.
18. Исходя из молярной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах.
Ответ: 2,0 × 10-23 г; 3,0 × 10-23 г.
19. На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NaOH. Вычислите число эквивалентности, молярную массу эквивалента и основность H3PO4 в этой реакции. На основании расчета напишите уравнение реакции.
Ответ: 0,5 моль; 49 г/моль; 2.
20. На нейтрализацию 0,943 г фосфористой кислоты H3PO4 израсходовано 1,291 г КОН. Вычислите число эквивалентности, молярную массу эквивалента и основность кислоты. На основании расчета напишите уравнение реакции.
Ответ: 0,5 моль; 41 г/моль; 2.
21. При сгорании 5,00 г металла образуется 9,44 г оксида металла. Определить молярную массу эквивалента металла.
Ответ: 9,01 г/моль.
22. Вычислите молярную массу двухвалентного металла и определите, какой это металл, если 8,34 г металла окисляются 0,680 л кислорода (н.у.).
Ответ: 137,4; Ва.
23. 1,00 г некоторого металла соединяется с 8,89 г брома и с 1,78 г серы. Найдите молярные массы эквивалентов брома и металла, зная, что молярная масса эквивалента серы равна 16,0 г/моль.
Ответ: 79,9 г/моль; 9,0 г/моль.
24. Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определите молярную массу эквивалента металла и объем выделившегося водорода (н.у.).
Ответ: 56,0 г/моль; 3,36 л.
25. 1,60 г кальция и 2,61 г цинка вытесняют из кислоты одинаковые количества водорода. Вычислите молярную массу эквивалента цинка, зная, что молярная масса эквивалента кальция равна 20,0 г/моль.
Ответ: 32,6 г/моль.
26. На нейтрализацию 2,45 г кислоты идет 2,00 г гидроксида натрия. Определите молярную массу эквивалента кислоты.
Ответ: 49,0 г/моль.
27. 0,376 г алюминия при взаимодействии с кислотой вытеснили 0,468 л водорода (н.у.). Определите эквивалентный объем водорода, зная, что молярная масса эквивалента алюминия равна 8,99 г/моль.
Ответ: 11,2 л/моль.
28. Сколько молекул содержится в 1,00 мл водорода при нормальных условиях?
Ответ: 2,69 . 1019.
29. Какой объем при нормальных условиях занимают 27. 1021 молекул газа?
Ответ: 1 дм3.
30. Масса 200 см3 ацетилена при нормальных условиях равна 0,232 г. Определите молярную массу ацетилена.
Ответ: 26,0 г/моль.
СТРОЕНИЕ АТОМА
Пример 1. Что такое квантовые числа? Какие значения они могут принимать?
Решение
Движение электрона в атоме носит вероятностный характер. Околоядерное пространство, в котором с наибольшей вероятностью (0,9 – 0,95) может находиться электрон, называется атомной орбиталью (АО). Атомная орбиталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n, l, ml). Квантовые числа принимают не любые, а определенные, дискретные (прерывные) значения. Соседние значения квантовых чисел различаются на единицу. Квантовые числа определяют размер (n), форму (l) и ориентацию (ml) атомной обитали в пространстве. Занимая ту или иную атомную орбиталь, электрон образует электронное облако, которое у электронов одного и того же атома может иметь различную форму (рис.1).
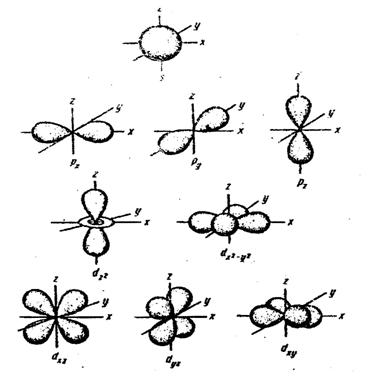
Рис. 1. Формы s-, p- и d- электронных облаков (орбиталей)
Формы электронных облаков аналогичны АО. Их также называют электронными или атомными орбиталями. Электронное облако характеризуется четырьмя квантовыми числами(n, l, ml, mS). Эти квантовые числа связаны с физическими свойствами электрона, и число n (главное квантовое число) характеризует энергетический (квантовый) уровень электрона; число l (орбитальное) – момент количества движения (энергетический подуровень), число ml (магнитное) – магнитный момент, mS – спин. Спин электрона возникает за счет вращения его вокруг собственной оси. Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в АО могут находиться не более двух электронов, отличающихся своими спинами (mS = ±1/2). В табл.3 (приложение) приведены значения и обозначения квантовых чисел, а также число электронов на соответствующем энергетическом уровне и подуровне.
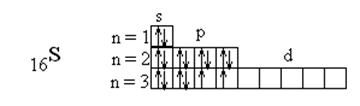
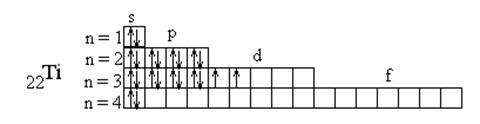
Пример 2. Составьте электронные формулы атомов элементов с порядковыми номерами 16 и 22. Покажите распределение электронов этих атомов по квантовым (энергетическим) ячейкам.
Решение
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n - главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение –s, p, d, f), x - число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n+l (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → (5d1) → 4f → 5d → 6p → 7s → (6d1-2) → 5f → 6d → 7p
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для элементов № 16 (сера) и № 22 (титан) электронные формулы имеют вид
16S 1s22s22p63s23p4
22Ti 1s22s22p63s23p63d24s2
Электронная структура атома может быть изображена также в виде схем размещения электронов в квантовых (энергетических) ячейках, которые являются схематическим изображением атомных орбиталей (АО). Квантовую ячейку обозначают в виде прямоугольника  , кружка
, кружка  или линейки
или линейки ----, а электроны в этих ячейках обозначают стрелками. В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами  ,
,  или
или  . В данном пособии применяют прямоугольники
. В данном пособии применяют прямоугольники  . Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда):
. Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда):
Пример 3. Определите число протонов и нейтронов в ядре атома железа.
Решение
1. Железо Fe в периодической системе элементов Д. И. Менделеева имеет порядковый номер 26, следовательно, число протонов в ядре атома равно 26, т.е. Z(Fe)=26.
2. Относительная атомная масса железа равна 56 (масса наиболее распространенного изотопа), т. е. Аr(Fе)=56. Используя формулу (Ar=Z+N, где Z – число протонов, N – число нейтронов), вычисляем число нейтронов в ядре атома 56Fe:
N(Fe) = Ar(Fe) – Z(Fe); N(Fe)=56 – 26 = 30
Таким образом, строение атома можно изобразить при помощи следующей краткой записи: 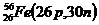 .
.
Пример 4. Изотоп 101-го элемента – менделевия (256) был получен бомбардировкой α-частицами ядер атомов эйнштейния (253). Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
Решение
Превращение атомных ядер обусловливается их взаимодействием с элементарными частицами или друг с другом. Ядерные реакции связаны с изменением состава ядер атомов химических элементов. С помощью ядерных реакций можно из атомов одних элементов получить атомы других.
Превращения атомных ядер, как при естественной, так и при искусственной радиоактивности записывают в виде уравнений ядерных реакций. При этом следует помнить, что суммы массовых чисел (цифры, стоящие у символа элемента вверху слева) и алгебраические суммы зарядов (цифры, стоящие у символа элемента внизу слева) частиц в левой и правой частях равенства должны быть равны. Данную ядерную реакцию выражают уравнением
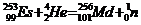
Часто применяют сокращенную форму записи, Для приведенной реакции она имеет вид:253Es(a, n)256Md. В скобках на первом месте пишут бомбардирующую частицу, а на втором, через запятую, - частицу, образующуюся при данном процессе. В сокращенных уравнениях частицы 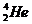 ,
, 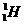 ,
, 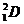 ,
, 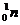 обозначают соответственно a, p, d, n.
обозначают соответственно a, p, d, n.
Пример 5. Исходя из сокращенных уравнений ядерных реакций
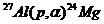 ;
; 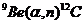 ;
; 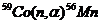 ;
; 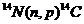 ;
; 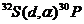
напишите их полные уравнения.
Решение
| Сокращенные уравнения | Полные уравнения |
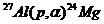
| 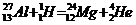
|
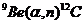
| 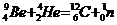
|
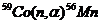
| 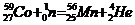
|
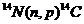
| 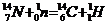
|
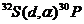
| 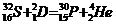
|
КОНТРОЛЬНЫЕ ВОПРОСЫ
31. Напишите электронные формулы атомов элементов с порядковыми номерами 9 и 28. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
32. Каково максимальное число электронов на 3- и 4-м энергетических уровнях? На каких подуровнях размещаются электроны в 3- и 4-м энергетических уровнях?
33. Могут ли атомы разных элементов иметь одинаковую массу? Как называются подобные атомы?
34. Медь имеет изотопы с массовыми числами 65 и 63. Укажите для каждого изотопа порядковый номер, число протонов и нейтронов, заряд ядра.
35. Напишите электронные формулы атомов элементов с порядковыми номерами 16 и 26. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
36. Какое максимальное число электронов могут занимать s-, p-, d- и f-орбитали данного энергетического уровня? Почему? Напишите электронную формулу атома элемента с порядковым номером 31.
37. Напишите электронные формулы атомов элементов с порядковыми номерами 25 и 34. К какому электронному семейству относится каждый из этих элементов?
38. Какие орбитали атома заполняются электронами раньше: 4s или 3d; 5s или 4p? Почему? Напишите электронную формулу атома элемента с порядковым номером 21.
39. Изотоп никеля – 57 образуется при бомбардировке a-частицами ядер атомов железа – 54. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
40. Какие орбитали атома заполняются электронами раньше: 4d или 5s; 6s или 5p? Почему? Напишите электронную формулу атома элемента с порядковым номером 43.
41. Что такое изотопы? Чем можно объяснить, что у большинства элементов периодической системы атомные массы выражаются дробным числом? Могут ли атомы разных элементов иметь одинаковую массу? Как называются подобные атомы?
42. Назовите элементы 4-, 5- и 6-го периодов, у атомов которых d-орбитали полностью заполнены электронами. Напишите электронные формулы атомов этих элементов и укажите, к какому периоду, группе и подгруппе периодической системы они относятся.
43. Каковы электронные структуры атома железа и иона железа Fe3+?
44. В каких группах и подгруппах периодической системы находятся s-элементы? Назовите их.
45. Изотоп кремния-30 образуется при бомбардировке a-частицами ядер атомов алюминия-27. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
46. Напишите электронные формулы атомов элементов с порядковыми номерами 14 и 40. Сколько свободных d-орбиталей у атомов последнего элемента?
47. Изотоп углерода-11 образуется при бомбардировке протонами ядер атомов азота-14. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
48. Неустойчивый изотоп 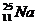 испускает b-частицу. В ядро, какого элемента он при этом превращается?
испускает b-частицу. В ядро, какого элемента он при этом превращается?
49. Какое целочисленное значение может принимать квантовое число l в зависимости от п?
50. Какие элементы в периодической системе называют s-, р-, d- и f -элементами?
51. Какое целочисленное значение может принимать квантовое число т в зависимости от l?
52. Каковы электронные структуры атома Ni0 и ионов Ni2+, Ni3+?
53. Что такое искусственные радиоизотопы, чем они отличаются от естественных радиоизотопов?
54. Напишите электронные формулы атомов элементов с порядковыми номерами 16 и 28. Чему равен максимальный спин p-электронов у атомов первого и d-электронов у атомов второго элемента?
55. Напишите электронные формулы атомов элементов с порядковыми номерами 21 и 23. Сколько свободных d-орбиталей в атомах этих элементов?
56. Сколько и какие значения может принимать магнитное квантовое число ml при орбитальном числе l = 0, 1, 2 и 3? Какие элементы в периодической системе называются s-, p-, d-, f-элементами? Приведите примеры.
57. Какие значения могут принимать квантовые числа n, l, ml, mS характеризующие состояние электронов в атоме? Какие значения они принимают для внешних электронов атома магния?
58. Какие из электронных формул, отражающих строение невозбужденного атома некоторого элемента неверны: а)1s22s22p53s1; б)1s22s22p6; в)1s22s22p63s23p63d4; г)1s22s22p63s23p64s2; д)1s22s22p63s23d2? Почему? Атомам, каких элементов отвечают правильно составленные электронные формулы?
59. Напишите электронные формулы атомов элементов с порядковыми номерами 24 и 33, учитывая, что у первого происходит «провал» одного 4s-электрона на 3d-подуровень. Чему равен максимальный спин d-электронов у атома первого и p-электронов у атома второго элементов?
60. Квантовые числа для электронов внешнего энергетического уровня атомов некоторого элемента имеют следующие значения: n = 4, l = 0, ml = 0, mS = ±1/2. Напишите электронную формулу атома этого элемента и определите, сколько свободных 3d -орбиталей он содержит.
61. В чем заключается принцип Паули? Может ли быть на каком-нибудь подуровне атома p7- или d12- электронов? Почему? Составьте электронную формулу атома элемента с порядковым номером 22 и укажите его валентные электроны.
62. Составьте электронные формулы атомов элементов с порядковыми номерами 32 и 42, учитывая, что у последнего происходит «провал» одного 5s-электрона на 4d–подуровень. К какому электронному семейству относится каждый из этих элементов?
63. Назовите элементы 1-, 2- и 3-го периодов, у атомов которых s -орбитали полностью заполнены электронами. Напишите электронные формулы атомов этих элементов и укажите, к какому периоду, группе и подгруппе периодической системы они относятся.
Периодическая система элементов Д.И. Менделеева
Пример 1. Какую высшую и низшую степени окисления проявляют мышьяк, селен и бром? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Решение
Высшую степень окисления элемента определяет номер группы периодической системы Д.М. Менделеева, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того количества электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2 np6).
Данные элементы находятся соответственно в VA, VIA, VIIA – группах и имеют структуру внешнего энергетического уровня s2p3,s2p4 и s2p5.
| Элемент | Степень окисления | Соединения | |
| высшая | низшая | ||
| As | +5 | -3 | H3AsО4;H3As |
| Se | +6 | -2 | SeO3;Na2Se |
| Br | +7 | -1 | KbrO4;KBr |
Пример 2. У какого из элементов четвертого периода – марганца или брома – сильнее выражены металлические свойства?
Решение
Электронные формулы данных элементов
25Mn 1s22s22p63s23p63d54s2
35Br 1s22s22p63s23p63d104s24p5
Марганец – d-элемент VIIB-группы, а бром – p-элемент VIIA-группы.
На внешнем энергетическом уровне у атома марганца два электрона, а у брома – семь. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а следовательно, тенденцией терять эти электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем уровне содержат более трех электронов, обладают определенным сродством к электрону, а следовательно, приобретают отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих p- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у марганца сильнее выражены, чем у брома.
Пример 3. Как зависят кислотно-основные свойства оксидов и гидроксидов от степени окисления атомов элементов, их образующих? Какие гидроксиды называются амфотерными (амфолитами)?
Решение
Если данный элемент проявляет переменную степень окисления и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства последних меняются от основных к амфотерным и кислотным. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э ---- О и О ---- Н может протекать по двум типам:
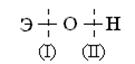
ЭОН 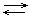 Э+ + ОН- ЭОН
Э+ + ОН- ЭОН 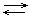 ЭО- + Н+
ЭО- + Н+
Полярность связей, в свою очередь, определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами атомов. Диссоциация по кислотному типу (II) протекает, если EO-H < EЭ-О (высокая степень окисления), а по основному типу, если EO-H > EЭ-О (низкая степень окисления). Если прочности связей О – Н и Э – О близки или равны, диссоциация гидроксида может одновременно протекать и по (I), и по (II) типам. В этом случае речь идет об амфотерных электролитах (амфолитах):
Эn+ + nOH- 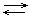 Э(OH)n = HnЭOn
Э(OH)n = HnЭOn 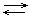 nH+ + Эonn–
nH+ + Эonn–
как основание как кислота
Э – элемент, n- его положительная степень окисления. В кислой среде амфолит проявляет основной характер, а в щелочной среде – кислый характер:
Ga(OH)3 + 3HCl = GaCl3 + 3H2O
Ga(OH)3 + 3NaOH = Na3GaO3 + 3H2O
КОНТРОЛЬНЫЕ ВОПРОСЫ
64. Исходя из положения германия и технеция в периодической системе, составьте формулы мета-, ортогерманиевой кислот и оксида технеция, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически.
65. Что такое энергия ионизации? В каких единицах она выражается? Как изменяется восстановительная активность s- и p-элементов в группах периодической системы с увеличением порядкового номера? Почему?
66. Что такое электроотрицательность? Как изменяется электроотрицательность p-элементов в периоде, в группе периодической системы с увеличением порядкового номера? Почему?
67. Исходя из положения германия, молибдена и рения в периодической системе, составьте формулы водородного соединения германия, оксида молибдена и рениевой кислоты, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически.
68. Что такое сродство к электрону? В каких единицах оно выражается? Как изменяется окислительная активность неметаллов в периоде и в группе периодической системы с увеличением порядкового номера? Ответ мотивируйте строением атома соответствующего элемента.
69. Составьте формулы оксидов и гидроксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления. Как изменяется кислотно-основной характер этих соединений при переходе от натрия к хлору? Напишите уравнения реакций, доказывающих амфотерность гидроксида алюминия.
70. Какой из элементов четвертого периода – ванадий или мышьяк – обладает более выраженными металлическими свойствами? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте, исходя из строения атомов данных элементов.
71. Марганец образует соединения, в которых он проявляет степень окисления +2, +3, +4, +6, +7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида марганца (IV).
72. У какого элемента четвертого периода – хрома или селена – сильнее выражены металлические свойства? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атомов хрома и селена.
73. Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Почему? Составьте формулы соединений алюминия с данными элементами в этой степени окисления. Как называются соответствующие соединения?
74. У какого из p-элементов пятой группы периодической системы – фосфора или сурьмы – сильнее выражены неметаллические свойства? Какое из водородных соединений данных элементов более сильный восстановитель? Ответ мотивируйте строением атомов этих элементов.
75. Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: Ba(OH)2 или Mg(OH)2; Ca(OH)2 или Fe(OH)2; Cd(OH)2 или Sr(OH)2?
76. Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: CuOH или Cu(OH)2; Fe(OH)2 или Fe(OH)3; Sn(OH)2 или Sn(OH)4? Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II).
77. Какую низшую степень окисления проявляют водород, фтор, сера и азот? Почему? Составьте формулы соединений кальция с данными элементами в этой их степени окисления. Как называются соответствующие соединения?
78. Какую низшую и высшую степени окисления проявляют кремний, мышьяк, селен и хлор? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
79. Хром образует соединения, в которых он проявляет степени окисления +2, +3, +6. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида хрома (III).
80. Атомные массы элементов в периодической системе непрерывно увеличиваются, тогда, как свойства простых тел изменяются периодически. Чем это можно объяснить? Дайте мотивированный ответ.
81. Какова современная формулировка периодического закона? Объясните, почему в периодической системе элементов аргон, кобальт, теллур и торий помещены соответственно перед калием, никелем, йодом и протактинием, хотя и имеют большую атомную массу?
82. Какую низшую и высшую степени окисления проявляют углерод, фосфор, сера и йод? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
83. Атомы, каких элементов четвертого периода периодической системы образуют оксид, отвечающий их высшей степени окисления Э2O5? Какой из них дает газообразное соединение с водородом? Составьте формулы кислот, отвечающих этим оксидам, и изобразите их графически.
84. Укажите, как в приведенном ряду элементов О – S – Se – Te изменяется способность принимать электроны, если известны величины электроотрицательности атомов этих элементов.
85. Как изменяются свойства элементов второго периода периодической системы с увеличением заряда ядра атома элемента? Ответ подтвердите характером формирования электронных оболочек атомов элементов.
86. Укажите, какое из сравниваемых двух соединений является более сильным основанием: а) NaOH или CsOH; б) Ca(OH)2 или Ba(OH)2; в) Zn(OH)2 или Cd(OH)2.
87. Элемент в периодической системе имеет порядковый номер 25. Какие оксиды образует этот элемент? Какие свойства проявляют оксиды этого элемента? Образует ли этот элемент газообразное соединение с водородом?
88. Какое строение электронных слоев у элементов подгруппы хрома при степени их окисления +3? Как изменяются основные свойства гидроксидов этих металлов по подгруппе сверху вниз?
89. Запишите электронные формулы атомов элементов № 24 и № 34. Почему они расположены в одном периоде (каком?) и в одной группе (какой?)?
90. Атомы какого из элементов VП-А подгруппы в большей степени проявляют восстановительные свойства по отношению к фтору?
91. Напишите электронные формулы ионов Se2- и Se6+. Почему для селена характерны как окислительные, так и восстановительные свойства?
92. Какой из атомов – хлор или йод – является окислителем при образовании молекулы IСl из атомов? У какого из этих атомов сильнее выражена способность притягивать к себе электроны?
93. На каком основании хром и сера, фосфор и ванадий расположены в одной группе периодической системы? Почему их помещают в разных подгруппах?
 2017-12-14
2017-12-14 976
976







