Пример 1. Какую валентность, обусловленную неспаренными электронами (спинвалентность), может проявлять фосфор в нормальном и возбужденном (*) состояниях?
Решение
Распределение электронов внешнего энергетического уровня фосфора …3s23p3 (учитывая правило Хунда, 3s23px3py3pz) поквантовым ячейкам имеет вид

Атомы фосфора имеют свободные d-орбитали, поэтому возможен переход одного 3s-электрона в 3d-состояние:

Отсюда валентность (спинвалентность) фосфора в нормальном состоянии равна трем, а в возбужденном – пяти.
Пример 2. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа ABn, если связь в них образуется за счет sp-, sp2-, sp3- гибридизации орбиталей атома A?
Решение
Теория валентных связей (ВС) предполагает участие в образовании ковалентных связей не только «чистых» АО, но и «смешанных», так называемых гибридных, АО. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и одинаковой энергии. Число гибридных орбиталей равно числу исходных.
| Тип молекулы | Исходные орбитали атома А | Тип гибридизации | Число гибридных орбиталей атома А | Пространственная конфигурация молекулы |
| AB2 | s + p | sp | Линейная | |
| AB3 | s + p + p | sp2 | Треугольная | |
| AB4 | s + p +p + p | sp3 | Тетраэдрическая |
Пример 3. Как метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов второго периода?
Решение
Метод валентных связей (ВС) не может объяснить целый ряд свойств и строение некоторых молекул (парамагнетизм молекулы О2; большую прочность связей в молекулярных ионах F+2 и O+2, чем, соответственно, в молекулах F2 и O2; наоборот, меньшую прочность связи в ионе N+2, чем в молекуле N2 ; существование молекулярного иона He+2 и неустойчивость молекулы He2 и т.п.). Более плодотворным оказался другой подход к объяснению ковалентной связи – метод молекулярных орбиталей (МО). В методе МО состояние молекулы описывается как совокупность электронных молекулярных орбиталей. При этом число молекулярных орбиталей равно сумме атомных орбиталей. Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между ядрами, способствует образованию химической связи и называется связывающей. Молекулярной орбитали, образовавшейся от вычитания атомных, соответствует более высокая энергия, чем атомным орбиталям. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими. Электроны, занимающие связывающие и разрыхляющие орбитали, называют соответственно связывающими (св) и разрыхляющими (разр) электронами. Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности:
σсв1s < σразр1s < σсв2s < σразр2s < σсв2px < πсв2py =
= πсв2pz < πразр2py = πразр2pz < σразр2px
На рисунке изображена энергетическая схема образования молекулярных орбиталей из атомных для двухатомных гомоядерных (одного и того же элемента) молекул элементов второго периода. Число связывающих и разрыхляющих электронов зависит от их числа в атомах исходных элементов.

Рис.2 Энергетическая схема образования молекулярных орбиталей из атомных для гомоядерных молекул второго периода.
Следует отметить, что при образовании молекул B2, C2, и N2 энергия связывающей s2px-орбитали больше энергии связывающих π2py- и π2pz-орбиталей, тогда как в молекулах O2 и F2, наоборот, энергия связывающих π2py- и π2pz-орбиталей больше энергии связывающей σ2px-орбитали. Это нужно учитывать при изображении энергетических схем (рис.) соответствующих молекул.
Порядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих орбиталей, деленной на два. Порядок связи может быть равен нулю (молекула не существует), целому или дробному положительному числу.
Подобно электронным формулам, показывающим распределение электронов в атоме по атомным орбиталям, в методе МО составляют формулы молекул, отражающие их электронную конфигурацию. По аналогии с атомными s-, p-, d-, f-орбиталями молекулярные орбитали обозначаются греческими буквами σ, π, δ, φ
Так, электронная конфигурация молекул О2 описывается следующим образом: O2[KK (σsсв)2 (σsразр)2 (σpxсв)2 (πpyсв)2(πpzсв)2πpyразрπpzразр]
Буквами КК показано, что четыре 1 s-электрона (два связывающих и два разрыхляющих) практически не оказывают влияния на химическую связь.
Пример 4. Сера образует химические связи с калием, водородом, бромом и углеродом. Какие из связей наиболее и наименее полярны? Укажите, в сторону какого атома смещается общая электронная пара?
Решение
Используя значения относительных электроотрицательностей атомов (табл. 4), находим разность относительных электроотрицательностей серы и элемента, образующего с ней химическую связь:
а) сера – калий: 2,6 – 0,91=1,69, электронная пара смещена в сторону атома серы;
б) сера – водород: 2,6 – 2,1=0,5, электронная пара смещена в сторону атома серы;
в) сера – бром: 2,6 – 2,74=-0,14, электронная пара смещена в сторону атома брома;
г) сера – углерод: 2,6 – 2,5=0,1, электронная пара смещена в сторону атома серы.
Чем больше по абсолютной величине разность относительных электроотрицательностей, тем более полярна связь. В данном примере наиболее полярной является связь сера – калий, наименее полярной – связь сера – углерод.
КОНТРОЛЬНЫЕ ВОПРОСЫ
94. Какую химическую связь называют ковалентною? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды?
95. Какую ковалентную связь называют полярной? Что служит количественной мерой полярности ковалентной связи? Исходя из значений электроотрицательности атомов соответствующих элементов определите, какая из связей:HI, HCl, BrF - наиболее полярна.
96. Какой способ образования ковалентной связи называют донорно-акцепторным? Какие химические связи имеются в ионах NH+4 и BF-4? Укажите донор и акцептор.
97. Как метод валентных связей (ВС) объясняет линейное строение молекулы BaCl2 и тетраэдрическое CH4?
98. Какую ковалентную связь называют σ-связью и какую π-связью? Разберите на примере строения молекулы азота.
99. Сколько неспаренных электронов имеет атом хлора в нормальном и возбужденном состояниях? Распределите эти электроны по квантовым ячейкам. Чему равна валентность хлора, обусловленная неспаренными электронами?
100. Распределите электроны атома серы по квантовым ячейкам. Сколько неспаренных электронов имеют ее атомы в нормальном и возбужденном состояниях? Чему равна валентность серы, обусловленная не спаренными электронами?
101. Что называют электрическим моментом диполя? Какая из молекул HCl, HBr, HI имеет наибольший момент диполя? Почему?
102. Какие кристаллические структуры называют ионными, молекулярными и металлическими? Кристаллы каких веществ: алмаз, хлорид натрия, диоксид углерода, цинк – имеют указанные структуры?
103. Как метод валентных связей (ВС) объясняет угловое строение молекул H2S и линейное молекулы СО2?
104. Нарисуйте энергетическую схему образования молекулы He2 и молекулярного иона He+2 по методу молекулярных орбиталей. Как метод МО объясняет устойчивость иона He+2 и невозможность существования молекулы He2?
105. Какую химическую связь называют водородной? Между молекулами, каких веществ она образуется? Почему H2O и HF, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги?
106. Какую химическую связь называют ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите два примера типичных ионных соединений. Напишите уравнения превращения соответствующих ионов в нейтральные атомы.
107. Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспаренных электронов, в соединениях CH4, CH3OH, HCOOH, CO2.
108. Какие силы молекулярного взаимодействия называют ориентационными, индукционными и дисперсионными? Когда возникают эти силы, и какова их природа?
109. Нарисуйте энергетическую схему образования молекулярного иона  и молекулы Н2 по методу молекулярных орбиталей. Где энергия связи больше? Почему?
и молекулы Н2 по методу молекулярных орбиталей. Где энергия связи больше? Почему?
110. Какие электроны атома бора участвуют в образовании ковалентных связей? Как метод валентных связей (ВС) объясняет симметричную треугольную форму молекулы BF3?
111. Нарисуйте энергетическую схему образования молекулы О2 по методу молекулярных орбиталей (МО). Как метод МО объясняет парамагнитные свойства молекулы кислорода?
112. Нарисуйте энергетическую схему образования молекулы F2 по методу молекулярных орбиталей (МО). Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле?
113. Нарисуйте энергетическую схему образования молекулы N2 по методу молекулярных орбиталей (МО). Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле?
114. Укажите тип химической связи в молекулах Н2, Cl2, HCl. Приведите схему перекрывания электронных облаков.
115. Пользуясь таблицей относительных электроотрицательностей, вычислите их разность для связей K – Cl, Ca – Cl, Fe –Cl, Ge –Cl. Какая из связей характеризуется наибольшей степенью ионности?
116. Какой характер имеют связи в молекулах NCl3, CS2, ICl5, NF3, OF2, ClF, CO2? Укажите для каждой из них направление смещения общей электронной пары.
117. Почему не могут существовать устойчивые молекулы Ве2 и Nе2?
118. Какие типы гибридизации АО углерода соответствуют образованию молекул СН4, С2Н2, С2Н4, С2Н6?
119. В молекулах SO2 и SO3 атом серы находится в состоянии sp2-гибридизации. Полярны ли эти молекулы? Какова их пространственная структура?
120. Какая из связей Са – Н, С – S, О –Cl является наиболее полярной? К какому из атомов смещено молекулярное электронное облако?
121. Как влияет увеличение кратности связи на ее энергию и длину?
122. Молекула хлорида бора BCl3 имеет плоскую структуру, а хлорида азота NCl3 – пирамидальную. Чем объясняется такое различие?
123. Какие гибридные облака атома углерода участвуют в образовании химической связи в молекулах CCl4, CO2?
Энергетика химических процессов
(термохимические расчеты)
При решении задач этого раздела используйте таблицу 5.
Науку о взаимных превращениях различных видов энергии называют термодинамикой. Термодинамика устанавливает законы этих превращений, а также направление самопроизвольного течения различных процессов в данных условиях.
При химических реакциях происходят глубокие качественные изменения в системе, рвутся связи в исходных веществах и возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии. В большинстве случаев этой энергией является теплота. Раздел термодинамики, изучающий тепловые эффекты химических реакций, называют термохимией. Реакции, которые сопровождаются выделением теплоты, называют экзотермическими, а те, которые сопровождаются поглощением теплоты, - эндотермическими. Теплоты реакций являются, таким образом, мерой изменения свойств системы, и знание их может иметь большое значение при определении условий протекания тех или иных реакций.
При любом процессе соблюдается закон сохранения энергии как проявление более общего закона природы: - закона сохранения материи. Теплота Q, поглощения системой, идет на изменение ее внутренней энергии ∆U и на совершение работы А: Q=∆U+A
Внутренняя энергия системы U- это общий ее запас, включающий энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов, внутриядерную энергию и т.д. Внутренняя энергия – полная энергия системы без потенциальной энергии, обусловленной положением системы в пространстве, и без кинетической энергии системы как целого. Абсолютное значение внутренней энергии U веществ неизвестно, так как нельзя привести систему в состояние, лишенное энергии. Внутренняя энергия, как и любой вид энергии, является функцией состояния, т.е. ее изменение однозначно определяется состоянием системы и не зависит от пути перехода, по которому протекает процесс ∆U = U2 – U1, где ∆U- изменение внутренней энергии системы при переходе от начального состояния U1 в конечное U2. Если U2 > U1, то ∆U > 0.Если U2 < U1, то ∆U < 0.
Теплота и работа функциями состояния не являются, ибо они служат формами передачи энергии и связаны с процессом, а не с состоянием системы. При химических реакциях А – это работа против внешнего давления, т.е. в первом приближении А = p∆V, где ∆V- изменение объема системы (V2 – V1). Так как большинство химических реакций проходит при постоянном давлении, то для изобарно-изотермического процесса (p-const, T-const) теплота Qp=∆U+p∆V; Qp=(U2-U1)+p(V2-V1); Qp=(U2+pV2)-(U1+pV1). Сумму U+pV обозначим через H, тогда Qp=H2-H1=∆H.
Величину Н называют энтальпией. Таким образом, теплота при p=const и T=const приобретает свойство функции состояния и не зависит от пути, по которому протекает процесс. Отсюда теплота реакции в изобарно-изотермическом процессе Qp равна изменению энтальпии системы ∆H (если единственным видом работы является работа расширения): Qp = ∆H.
Энтальпия, как и внутренняя энергия, является функцией состояния; ее изменение (∆H) определяется только начальными и конечными состояниями системы и не зависит от пути перехода. Нетрудно видеть, что теплота реакции в изохорно-изотермическом процессе (V = const, T = const), при котором ∆V = 0, равна изменению внутренней энергии системы: QV = ∆U.
Теплоты химических процессов, протекающих при p, T=const и V, T = const, называют тепловыми эффектами.
При экзотермических реакциях энтальпия системы уменьшается и ∆H < 0 (Н2 < Н1), а при эндотермических энтальпия системы увеличивается ∆H >0 (Н2 > Н1). В дальнейшем тепловые эффекты всюду выражается через ∆rH.
Термохимические расчеты основаны на законе Гесса (1840): тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
Часто в термохимических расчетах применяют следствие из закона Гесса: тепловой эффект реакции (∆rH) равен сумме теплот образования (∆fH) продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции
∆rH = ∑ ni∆fHпрод – ∑ nj∆fHисх (4)
Пример 1. При взаимодействии кристаллов хлорида фосфора (V) с парами воды образуется жидкий РОCl3 и хлористый водород. Реакция сопровождается выделением 111,4 кДж теплоты. Напишите термохимическое уравнение этой реакции.
Решение
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также численное значение тепловых эффектов, называют термохимическими. В термохимических реакциях, если это специально не оговорено, указывается значения тепловых эффектов при постоянном давлении Qp, равные изменению энтальпии системы ∆rH.
Значение ∆rH приводят обычно в правой части уравнения, отделяя его запятой или точкой с запятой. Приняты следующие сокращенные обозначения агрегатного состояния веществ: г – газообразное, ж – жидкое, к – кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно. Если в результате реакции выделяется теплота, то ∆rH < 0.
Учитывая сказанное, составляем термохимическое уравнение данной в примере реакции:
PCl5(к) + H2O(г) = POCl3(ж) + 2HCl(г); ∆rH = -111,4 кДж.
Пример 2: Вычислите теплоту образования аммиака, исходя из реакции:
2NH3(г) + 1,5O2(г)®N2(г) + 3H2O(ж) DrH = -766кДж
Теплота образования воды равна –286, 2 кДж/моль
Решение:
Теплотой образования (энтальпией) данного соединения называют тепловой эффект реакции образования 1 моль этого соединения из простых веществ, взятых в их устойчивом состоянии при данных условиях. Обычно теплоты образования относят к стандартному состоянию, т.е. 25 градусов Цельсия (298 К) и 1,013 × 105 Па, и обозначают через  .
.
Согласно следствия закона Гесса (тепловой эффект химической реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом стехиометрических коэффициентов)
DrH =  .
.
Отсюда находим
 .
.
Так как теплоты образования простых веществ в стандартном состоянии равны нулю, следовательно 
Пример 3. Реакция горения этана выражается термохимическим уравнением.
C2H6(г) + 3½O2 = 2CO2(г) + 3H2O(ж); ∆rH = -1559,87 кДж.
Вычислите теплоту образования этана, если известны теплоты образования CO2(г) и H2O(ж) (табл.5).
Решение
Необходимо вычислить тепловой эффект реакции, термохимическое уравнение которой имеет вид
2С(графит) + 3H2(г) = C2H6(г); ∆rH=?
Исходя из следующих данных:
а) C2H6(г) + 3½O2(г) = 2CO2(г) + 3 H2O(ж); ∆rH = -1559,87 кДж.
б) С(графит) + O2(г) = CO2(г); ∆rH = -393,51 кДж.
в) H2(г) + ½O2 = H2O(ж); ∆rH = -285,84 кДж.
На основании закона Гесса с термохимическими уравнениями можно оперировать так же, как и с алгебраическими. Для получения искомого результата следует уравнение (б) умножить на 2, уравнение (в) – на 3, а затем сумму этих уравнений вычесть из уравнения (а):
C2H6 + 3½O2 – 2С – 2O2 – 3H2 – 3/2O2 = 2CO2 + 3H2O – 2CO2 – 3H2O
∆rH = -1559,87 – 2 × (-393,51) – 3 × (-285,84);
∆rH = -1559,87 + 787,02 + 857,52; C2H6=2С+3H2;
∆rH = +84,67 кДж.
Так как теплота образования равна теплоте разложения с обратным знаком, то  = -84,67 кДж. К тому же результату придем, если для решения задачи применить вывод из закона Гесса:
= -84,67 кДж. К тому же результату придем, если для решения задачи применить вывод из закона Гесса:
∆rH =2  + 3
+ 3  –
–  – 3½
– 3½ 
Учитывая, что стандартные теплоты образования простых веществ условно приняты равными нулю,
 = 2
= 2  + 3
+ 3  – ∆rH
– ∆rH
 = 2 × (-393,51) + 3 × (-285,84) + 1559,87;
= 2 × (-393,51) + 3 × (-285,84) + 1559,87;
 = -84,67 кДж.
= -84,67 кДж.
Пример 4. Реакция горения этилового спирта выражается термохимическим уравнением: C2H5OH(ж) + 3O2(г) = 2СО2(г) + 3Н2О(ж); ∆rH =?
Вычислите тепловой эффект реакции, если известно, что мольная (молярная) теплота парообразования C2H5OH(ж) равна +42,36 кДж и известны теплоты образования: C2H5OH(ж); CO2(г); H2O(ж) (см. табл. 5).
Решение
Для определения ∆rH реакции необходимо знать теплоту образования C2H5OH(ж). Последнюю находим из данных:
C2H5OH(ж) = C2H5OH(г); ∆rH = +42,36 кДж.
+42,36 = -236,31 –  ;
;
 = -235,31 – 42,36 = -277,67 кДж.
= -235,31 – 42,36 = -277,67 кДж.
Вычисляем ∆rH реакции, применяя следствия из закона Гесса:
∆rH = 2 × (-393,51) + 3 × (-285,84) + 277,67 = -1386,87 кДж.
КОНТРОЛЬНЫЕ ВОПРОСЫ
124. Вычислите, какое количество теплоты выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа.
Ответ: 2543,1 кДж.
125. Газообразный этиловый спирт C2H5OH можно получить при взаимодействии этилена C2H4(г) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
Ответ: -45,76 кДж.
126. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
FeO(к) + CO(г) = Fe(к) + CO2(г); ∆rH = -13,18 кДж.
CO(г) + ½O2(г) = CO2(г); ∆rH = -283,0 кДж.
H2(г) + ½O2(г) = H2O(г); ∆rH = -241,83 кДж.
Ответ: +27,99 кДж.
127. При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод CS2(г). Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
Ответ: +65,43 кДж.
128. Напишите термохимическое уравнение реакции между СО(г) и водородом, в результате которой образуются CH4(г) и H2O(г). Сколько теплоты выделится при этой реакции, если было получено 67,2 дм3 метана в пересчете на нормальные условия?
Ответ: 618,48 кДж.
129. Тепловой эффект какой реакции равен теплоте образования NO? Вычислите теплоту образования NO, исходя из следующих термохимических уравнений:
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(ж); ∆rH = -1168,80 кДж.
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж); ∆rH = -1530,28 кДж.
Ответ: 90,37 кДж/моль.
130. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия?
Ответ: 78,97 кДж.
131. Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений: H2(г) + ½O2(г) = H2O(ж); ∆rH= -285,84 кДж.
C(к) + O2(г) = CO2(г); ∆rH= -393,51 кДж.
CH4(г) + 2O2(г) = 2H2O(ж) + CO2(г); ∆rH= -890,31 кДж.
Ответ: -74,88 кДж/моль.
132. Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Ca(к) + ½O2(г) = CaO(к); ∆rH = -635,60 кДж.
H2(г) + ½O2(г) = H2O(ж); ∆rH = -285,84 кДж.
CaO(к) + H2O(ж) = Ca(OH)2(к); ∆rH= -65,06 кДж.
Ответ: -986,50 кДж/моль.
133. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен –3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования C6H6(ж).
Ответ: +49,03 кДж/моль.
134. Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды?
Ответ: 924,88 кДж.
135. При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия?
Ответ: 452,37 кДж.
136. Реакция горения метилового спирта выражается термохимическим уравнением: CH3OH(ж) + 3/2O2(г) = CO2(г) + 2H2O(ж); ∆rH =?
Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования CH3OH (ж) равна +37,4 кДж.
Ответ: -726,62 кДж.
137. При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования C2H5OH(ж).
Ответ: -277,67 кДж/моль.
138. Реакция горения бензола выражается термохимическим уравнением
C6H6(ж) + 7½O2(г) = 6CO2(г) + 3H2O(г); ∆rH =?
Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования бензола равна +33,9 кДж.
Ответ: -3135,58 кДж.
139. Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения 1 моль этана C2H6(г), в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 1 м3 этана в пересчете на нормальные условия?
Ответ: 63742,86 кДж.
140. Реакция горения аммиака выражается термохимическим уравнением
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж); ∆rH = -1530,28 кДж.
Вычислите теплоту образования NH3(г).
Ответ: -46,19 кДж/моль.
141. При взаимодействии 6,3 г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа FeS.
Ответ: -100,26 кДж/моль.
142. При сгорании 1 дм3 ацетилена (н.у.) выделяется 56,053 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования C2H2(г).
Ответ: 226,75 кДж/моль.
143. При получении эквивалентной массы гидроксида кальция из CaO(к) и Н2О(ж) выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция.
Ответ: -635,6 кДж/моль.
144. Определите стандартную энтальпию (∆fН°298) образования РН3, исходя из уравнения 2РН3(г) + 4О2(г) = Р2О5(к) + 3Н2О(ж), ∆rН°298= -2360 кДж.
Ответ: 5,3 кДж/моль.
145. Исходя из уравнения реакции СН3ОН(ж) + 3/2О2(г) = СО2(г) + Н2О(ж), ∆rН°298 = -726,5 кДж, определите стандартную энтальпию образования метилового спирта (∆fН°298(СН3ОН(ж))).
Ответ: -238,6 кДж/моль.
146. При восстановлении 12,7 г оксида меди (II) углем (с образованием СО) поглощается 8,24 кДж. Определите ∆fН°298(СuО).
Ответ: -162,1 кДж/моль.
147. При полном сгорании этилена (с образованием жидкой воды) выделилось 6226 кДж. Найдите объем вступившего в реакцию кислорода (н.у.).
Ответ: 296,5 дм3.
Химическое сродство
При решении задач этого раздела см. табл. 5.
Самопроизвольно могут протекать реакции, сопровождающиеся не только выделением, но и поглощением теплоты.
Реакция, идущая при данной температуре с выделением теплоты, при другой температуре проходит с поглощением теплоты. Здесь проявляется диалектический закон единства и борьбы противоположностей. С одной стороны, система стремится к упорядочению (агрегации), к уменьшению Н; с другой стороны, система стремится к беспорядку (дезагрегации). Первая тенденция растет с понижением, а вторая с повышением температуры. Тенденцию к беспорядку характеризует величина, которую называют энтропией.
Энтропия S, так же как внутренняя энергия U, энтальпия H, объем V и др., является свойством вещества, пропорциональным его количеству. S, U, H, V обладают аддитивными свойствами, т.е. при соприкосновении системы суммируются. Энтропия отражает движение частиц вещества и является мерой неупорядоченности системы. Она возрастает с увеличением движения частиц: при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п. Процессы, связанные с упорядоченностью системы: конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация и т.п., ведут к уменьшению энтропии. Энтропия является функцией состояния, т.е. ее изменение (∆S) зависит только от начального (S1) и конечного (S2) состояния и не зависит от пути процесса:
 (5)
(5)
∆rS = S2 – S1. Если S2 > S1, то ∆S > 0. Если S2 < S1, то ∆S < 0.
Так как энтропия растет с повышением температуры, то можно считать, что мера беспорядка» Т∆S. Энтропия выражается в Дж/ (моль × К). Таким образом, движущая сила процесса складывается из двух сил: стремления к упорядочению (Н) и стремления к беспорядку (TS). При Р = const и Т = const общую движущую силу процесса, которую обозначают ∆G, можно найти из соотношения: ∆G = (Н2 – Н1) – (TS2 – TS1); ∆G = ∆Н – Т∆S.
Величина G называется изобарно-изотермическим потенциалом или энергией Гиббса. Итак, мерой химического сродства является убыль энергии Гиббса (∆G), которая зависит от природы вещества, его количества и от температуры. Энергия Гиббса является функцией состояния, поэтому
 (6)
(6)
Самопроизвольно протекающие процессы идут в сторону уменьшения потенциала и, в частности, в сторону уменьшения DrG. Если ∆rG < О, процесс принципиально осуществим; если ∆rG > O, процесс самопроизвольно проходить не может. Чем меньше ∆rG, тем сильнее стремление к протеканию данного процесса и тем дальше он состояния равновесия, при котором ∆rG = 0 и ∆rН = Т × ∆rS.
Из соотношения ∆rG = ∆rН – Т×∆rS (7) видно, что самопроизвольно могут протекать и процессы, для которых ∆rН > О (эндотермические). Это возможно, когда ∆rS > О, но |T∆rS| > |∆rH|, и тогда ∆rG < O. С другой стороны, экзотермические реакции (∆rН < О) самопроизвольно не протекают, если при ∆rS < 0 окажется, что ∆rG>O.
Пример 1. В каком состоянии энтропия 1 моль вещества больше, в кристаллическом или парообразном при той же температуре?
Решение
Энтропия есть мера неупорядоченности состояния вещества. В кристалле частицы (атомы, ионы) расположены упорядоченно и могут находиться лишь в определенных точках пространства, а для газа таких ограничений нет. Объем 1 моль газа гораздо больше, чем объем 1 моль кристаллического вещества; возможность хаотичного движения молекул газа больше. А так как энтропию можно рассматривать как количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия 1 моль паров вещества больше энтропии 1 моль его кристаллов при одинаковой температуре.
Пример 2. Прямая или обратная реакция будет протекать при стандартных условиях в системе
CH4(г) + CO2(г) ↔ 2СО(г) + 2H2(г)?
Решение
Для ответа на вопрос следует вычислить  прямой реакции. Значения
прямой реакции. Значения  соответствующих веществ приведены в табл. 5. Зная, что
соответствующих веществ приведены в табл. 5. Зная, что  есть функция состояния и что
есть функция состояния и что  для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим
для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим  процесса из соотношения 6:
процесса из соотношения 6:
 =
=  = [2 × (-137,27)+ + 2 × (0)] – [(-50,79) + (-394,38)] = +170,63 кДж.
= [2 × (-137,27)+ + 2 × (0)] – [(-50,79) + (-394,38)] = +170,63 кДж.
То что  > 0, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298 К и равенстве давлений взятых газов 1,013 × 105 Па (760 мм рт.ст. = 1 атм.).
> 0, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298 К и равенстве давлений взятых газов 1,013 × 105 Па (760 мм рт.ст. = 1 атм.).
Пример 3. На основании стандартных теплот образования и абсолютных стандартных энтропий веществ (табл. 5) вычислите  реакции, протекающей по уравнению СО(г) + Н2О(ж) = СО2(г) + Н2(г).
реакции, протекающей по уравнению СО(г) + Н2О(ж) = СО2(г) + Н2(г).
Решение
 =
=  ; где
; где  и
и  - функции состояния, поэтому
- функции состояния, поэтому
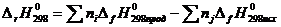 ;
; 
 = (-393,51 + 0) – (-110,52 – 285,84) = +2,85 кДж,
= (-393,51 + 0) – (-110,52 – 285,84) = +2,85 кДж,
 = (213,65 + 130,59) – (197,91 + 69,94) = +76,39 Дж/моль = 0,07639 кДж/К,
= (213,65 + 130,59) – (197,91 + 69,94) = +76,39 Дж/моль = 0,07639 кДж/К,  = +2,85 – 298 × 0,07639 = -19,91 кДж.
= +2,85 – 298 × 0,07639 = -19,91 кДж.
Пример 4. Реакция восстановления Fe2O3 водородом протекает по уравнению Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2О(г);  =+96,61 кДж. Возможна ли эта реакция при стандартных условиях, если изменение энтропии
=+96,61 кДж. Возможна ли эта реакция при стандартных условиях, если изменение энтропии  = 0,1387 кДж/моль)? При какой температуре начнется восстановление Fe2О3?
= 0,1387 кДж/моль)? При какой температуре начнется восстановление Fe2О3?
Решение
Вычисляем  реакции:
реакции:  =
=  = 96,61 – 298 × 0,1387 = +55,28 кДж. Так как
= 96,61 – 298 × 0,1387 = +55,28 кДж. Так как  > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой
> 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой  = 0:
= 0:
 =
=  ;
;  К
К
Следовательно, при температуре» 696,5 К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
Пример 5. Вычислите  ,
,  ,
,  реакции, протекающей по уравнению: Fe2O3( т ) + 3С(графит) = 2Fe (т) + 3СО(г). Возможна ли реакция восстановления Fe2O3 углеродом при температурах 500 и 1000 К?
реакции, протекающей по уравнению: Fe2O3( т ) + 3С(графит) = 2Fe (т) + 3СО(г). Возможна ли реакция восстановления Fe2O3 углеродом при температурах 500 и 1000 К?
Решение
 и
и  находим из соотношений (4) и (5):
находим из соотношений (4) и (5):
 = (3× (-110,52) + 2× 0) – (-822,10 + 3× 0) = -331,56 + 822,10 = +490,54 кДж;
= (3× (-110,52) + 2× 0) – (-822,10 + 3× 0) = -331,56 + 822,10 = +490,54 кДж;
 = (2×27,2 + 3×197,91) – (89,96 + 3×5,69) = 541,1 Дж/К
= (2×27,2 + 3×197,91) – (89,96 + 3×5,69) = 541,1 Дж/К
Энергию Гиббса при соответствующих температурах находим из соотношения 7:  =
= 
 = 490,54 – 500 × 541,1/1000 = +219,99 кДж;
= 490,54 – 500 × 541,1/1000 = +219,99 кДж;
 = 490,54 – 1000 × 541,1/1000 = -50,56 кДж.
= 490,54 – 1000 × 541,1/1000 = -50,56 кДж.
Так как  > 0, а
> 0, а  < 0, то восстановление Fe2O3 углеродом возможно при 1000 К и невозможно при 500 К.
< 0, то восстановление Fe2O3 углеродом возможно при 1000 К и невозможно при 500 К.
Контрольные вопросы
148. Вычислите  для следующих реакций:
для следующих реакций:
а) 2NaF(к) + Cl2(г) = 2NaCl(к) + F2(г)
б) PbO2(к) + 2Zn(к) = Pb(к) + 2ZnO(к)
Можно ли получить фтор по реакции (а) и восстановить PbO2 цинком по реакции (б)?
Ответ: +313,94 кДж; -417,4 кДж.
149. При какой температуре наступит равновесие системы
4HCl(г) + O2(г)  2H2O(г) + 2Cl2(г);
2H2O(г) + 2Cl2(г);  =-114,42 кДж?
=-114,42 кДж?
Хлор или кислород в этой системе является более сильным окислителем и при каких температурах?
Ответ: 891 К.
150. Восстановление Fe3O4 оксидом углерода идет по уравнению
Fe3O4(к) + CO(г) = 3FeO(к) + CO2(г).
Вычислите  и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно
и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно  в этом процессе?
в этом процессе?
Ответ: +24,19 кДж; +31,34 Дж/К.
151. Реакция горения ацетилена идет по уравнению
С2Н2(г) + 5/2O2(г) = 2CO2(г) + H2O(ж)
Вычислите  и
и  . Объясните уменьшение энтропии в результате этой реакции.
. Объясните уменьшение энтропии в результате этой реакции.
Ответ: -1235,15 кДж; -216,15 Дж/К.
152. Уменьшается или увеличивается энтропия при переходах: а)воды в пар; б)графита в алмаз? Почему? Вычислите  для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях.
для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях.
Ответ: а) 118,78 Дж/К; б) –3,25 Дж/К.
153. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция Н2(г) + CO2(г) = CO(г) + H2O(ж);  = -2,85 кДж?
= -2,85 кДж?
Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите  этой реакции.
этой реакции.
Ответ: +19,91 кДж.
154. Прямая или обратная реакция будет протекать при стандартных условиях в системе: 2NO(г) + O2(г)  2NO2(г). Ответ мотивируйте, вычислив
2NO2(г). Ответ мотивируйте, вычислив  прямой реакции.
прямой реакции.
Ответ: -69,70 кДж.
155. Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите  реакции, протекающей по уравнению: NH3(г) + HCl(г) = NH4Cl(к). Может ли эта реакция при стандартных условиях идти самопроизвольно?
реакции, протекающей по уравнению: NH3(г) + HCl(г) = NH4Cl(к). Может ли эта реакция при стандартных условиях идти самопроизвольно?
Ответ: -92,08 кДж.
156. При какой температуре наступит равновесие системы:
157. СО(г) + 2H2(г)  CH3OH(ж);
CH3OH(ж);  = -128,05 кДж?
= -128,05 кДж?
Ответ:» 385,5 К.
158. При какой температуре наступит равновесие системы:
СН4(г) + CO2(г)  2CO(г) + 2H2(г);
2CO(г) + 2H2(г);  = +247,37 кДж?
= +247,37 кДж?
Ответ:» 961,9 К.
159. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите  реакции, протекающей по уравнению: 4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г). Возможна ли эта реакция при стандартных условиях?
реакции, протекающей по уравнению: 4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г). Возможна ли эта реакция при стандартных условиях?
Ответ: -957,77 кДж.
160. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите  реакции, протекающей по уравнению: СО2(г) + 4H2(г) = CH4(г) + 2H2O(ж). Возможна ли эта реакция при стандартных условиях?
реакции, протекающей по уравнению: СО2(г) + 4H2(г) = CH4(г) + 2H2O(ж). Возможна ли эта реакция при стандартных условиях?
Ответ: -130,89 кДж.
161. Вычислите  ,
,  ,
,  реакции, протекающей по уравнению
реакции, протекающей по уравнению
Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3H2O(г).
Возможна ли реакция восстановления Fe2O3 водородом при температурах 500 и 2000 К?
Ответ: +96,61 кДж; 138,83 Дж/К; 27,2 кДж; -181,06 кДж.
162. Какие из карбонатов: ВеСО3, CaCO3 или ВаСО3 – можно получить по реакции взаимодействия соответствующих оксидов с СО2? Какая реакция идет наиболее энергично? Вывод сделайте, вычислив  реакций.
реакций.
Ответ: +31,24 кДж; -130,17 кДж; -216,02 кДж.
163. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите  реакции, протекающей по уравнению: СО(г) + 3H2(г) = CH4(г) + H2O(г). Возможна ли эта реакция при стандартных условиях?
реакции, протекающей по уравнению: СО(г) + 3H2(г) = CH4(г) + H2O(г). Возможна ли эта реакция при стандартных условиях?
Ответ; -142,16 кДж.
164. Вычислите  ,
,  и
и  реакции, протекающей по уравнению:
реакции, протекающей по уравнению:
TiO2(к) + 2C(к) = Тi(к) + 2CO(г). Возможна ли реакция восстановления TiO2 углеродом при температурах 1000 и 3000К?
Ответ: +722,86 кДж; 364,84 Дж/K; +358,02 кДж; -371,66 кДж.
165. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите  реакции, протекающей по уравнению: С2Н4(г) + 3O2(г) = 2CO2(г) + 2H2O(ж). Возможна ли эта реакция при стандартных условиях?
реакции, протекающей по уравнению: С2Н4(г) + 3O2(г) = 2CO2(г) + 2H2O(ж). Возможна ли эта реакция при стандартных условиях?
Ответ: -1331,21 кДж.
166. Определите, при какой температуре начнется реакция восстановления Fe3O4, протекающая по уравнению: Fe3O4(к) + CO(г) = 3FeO(к) + CO2(г);  = +34,55 кДж.
= +34,55 кДж.
Ответ:1102,4 К.
167. Вычислите, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по уравнению: PCl5(г) = PCl3(г) + Cl2(г);  = +92,59 кДж.
= +92,59 кДж.
Ответ: 509 К.
Вычислите изменение энтропии для реакций протекающих по уравнениям: 2СН4(г) = C2H2(г) + 3H2(г);
N2(г) + 3H2(г) = 2NH3(г);
C(графит) + О2(г) = CO2(г).
Почему в этих реакциях  > 0; < 0; = 0?
> 0; < 0; = 0?
Ответ: 220,21 Дж/K; -198,26 Дж/К; 2,93 Дж/К.
168. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите  реакции, протекающей по уравнению 2Н2(г) + СО(г) = СН3ОН(г). Возможна ли эта реакция при стандартных условиях?
реакции, протекающей по уравнению 2Н2(г) + СО(г) = СН3ОН(г). Возможна ли эта реакция при стандартных условиях?
Ответ: 155,65 кДж.
169. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите  реакции, протекающей по уравнению С2Н6(г) = С2Н4(г) + Н2(г). Возможна ли эта реакция при стандартных условиях?
реакции, протекающей по уравнению С2Н6(г) = С2Н4(г) + Н2(г). Возможна ли эта реакция при стандартных условиях?
Ответ: 101,04 кДж.
170. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите  реакции, протекающей по уравнению С(графит) + Н2О(г) = СО(г) + Н2(г). Возможна ли эта реакция при стандартных условиях?
реакции, протекающей по уравнению С(графит) + Н2О(г) = СО(г) + Н2(г). Возможна ли эта реакция при стандартных условиях?
Ответ: 91,3 кДж.
171. Вычислите изменение энтропии для реакций, протекающих по уравнениям: а) 4НСl(г) + О2(г) = 2Н2О(ж) + 2Сl2(г);
б) С(графит) + Н2О(г) = СО(г) + Н2(г).
Объясните знак изменения энтропии.
Ответ: а) –366,33 Дж/К; б) 133,6 Дж/К.
172. Вычислите изменение энтропии для реакций, протекающих по уравнениям: а) 2SО2(г) + О2(г) = 2SО3(г);
б) 2НСl(г) = Н2(г) + Сl2(г);
в) 2СО2(г) = 2СО(г) + О2(г).
Объясните знак изменения энтропии.
Ответ: а) –187,8 Дж/К; б) 20,2 Дж/К; в) 172,67 Дж/К.
173. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите  реакции, протекающей по уравнению 2NO2(г) = 2NО(г) + О2(г). Возможна ли эта реакция при стандартных условиях?
реакции, протекающей по уравнению 2NO2(г) = 2NО(г) + О2(г). Возможна ли эта реакция при стандартных условиях?
Ответ: 69,70 кДж.
174. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите  реакции, протекающей по уравнению PbO(к) + С(графит) = СО(г) + Pb(к). Возможна ли эта реакция при стандартных условиях?
реакции, протекающей по уравнению PbO(к) + С(графит) = СО(г) + Pb(к). Возможна ли эта реакция при стандартных условиях?
Ответ: 51,22 кДж.
175. Вычислите изменение энтропии для реакций, протекающих по уравнениям: а) СО2(г) + 4Н2(г) = СН4(г) + 2Н2О(г); б) СО(г) + 3Н2(г) = СН4(г) + Н2О(г). Объясните знак изменения энтропии.
Ответ: а) –172,33 Дж/К; б) –214,27 Дж/К.
176. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите  реакции, протекающей по уравнению 2SО2(г) + Н2S(г) = 3S(к) + 2Н2О(ж). Возможна ли эта реакция при стандартных условиях?
реакции, протекающей по уравнению 2SО2(г) + Н2S(г) = 3S(к) + 2Н2О(ж). Возможна ли эта реакция при стандартных условиях?
Ответ: -108,59 кДж.
177. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите  реакции, протекающей по уравнению N2(г) + 2Н2О(ж) = NН4NО3(к). Возможна ли эта реакция при стандартных условиях?
реакции, протекающей по уравнению N2(г) + 2Н2О(ж) = NН4NО3(к). Возможна ли эта реакция при стандартных условиях?
Ответ: 590,94 кДж.
Химическая кинетика и равновесие
Кинетика – учение о скорости различных процессов, в том числе химических. Критерием принципиальной осуществимости реакций является неравенство  < 0. Но это неравенство не является еще полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так,
< 0. Но это неравенство не является еще полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так,  (Н2О(г)) = -228,59 кДж/моль, а
(Н2О(г)) = -228,59 кДж/моль, а  (AlI3(к)) = -313,8 кДж/моль и, следовательно, при Т = 298 К и Р = 1,013 × 105 Па возможны реакции, идущие по уравнениям:
(AlI3(к)) = -313,8 кДж/моль и, следовательно, при Т = 298 К и Р = 1,013 × 105 Па возможны реакции, идущие по уравнениям:
Н2(г) + 1/2O2(г) = H2O(г) (1)
2Al(к) + 3I2(к) = 2AlI3(к) (2)
Однако эти реакции при стандартных условиях идут только в присутствии катализатора (платины для первой и воды для второй). Катализатор как бы снимает кинетический “тормоз”, и тогда проявляется термодинамическая природа вещества. Скорость химической реакции зависит от многих факторов, основные из которых – концентрация (давление) реагентов, температура и действие катализатора. Эти же факторы определяют и достижение равновесия в реагирующей системе.
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе: 2SO2(г) + O2(г)  2SO3(г), если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
2SO3(г), если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Решение
Обозначим концентрации реагирующих веществ: [SO2] = а, [O2] = b, [SO3] = c. Согласно закону действия масс скорости и прямой и обратной реакций до изменения объема: uпр = k×а2×b (8); uобр = k1×с2 (9)
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3a, [O2] = 3b, [SO3] = 3c. При новых концентрациях скорости u' прямой и обратной реакций: u'пр = k×(3a)2×(3b) = 27×k×a2×b; u'обр = k1×(3с)2 = 9×k1×с2. Отсюда
 ;
;  .
.
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в девять раз. Равновесие системы сместилось в сторону образования SO3.
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 0С, если температурный коэффициент реакции равен 2.
Решение
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант – Гоффа по формуле:  (10).
(10).
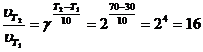
Следовательно, скорость реакции  при температуре 70 0С больше скорости реакции
при температуре 70 0С больше скорости реакции  при температуре 30 0С в 16 раз.
при температуре 30 0С в 16 раз.
Пример 3. Константа равновесия гомогенной системы:
СО(г) + Н2О(г)  СО2(г) + Н2(г)
СО2(г) + Н2(г)
при 850оС равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: ССО = 3моль/л,  = 2моль/л.
= 2моль/л.
Решение
При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
uпр = k1×[CO]×[H2O]; uобр = k 2×[CO2]×[H2];
 (11)
(11)
В условии задачи даны исходные концентрации, тогда как в выражение Кс входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [CO2] = х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ:
[CO2] = [H2]= х моль/л; [CO] = (3 – х) моль/л; [H2O] = (2 – х) моль/л.
Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ:  ;
;
х2= 6 – 2х – 3х + х2; 5х = 6, х = 1,2 моль/л.
Таким образом, искомые равновесные концентрации: [CO2] =1,2 моль/л; [H2] =1,2 моль/л; [CO] =3 – 1,2 =1,8 моль/л; [H2O] =2 – 1,2 = 0,8 моль/л.
Пример 4. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению: РСl5(г)  РСl3(г) + Сl2(г); ∆rН = + 92,59 кДж.
РСl3(г) + Сl2(г); ∆rН = + 92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения РСl5?
Решение
Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения PCl5 эндотермическая (∆rН > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение PCl5 ведет к увеличению объема газообразных веществ (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещение равновесия в указанном направлении можно достигнуть как увеличением концентрации PCl5, так и уменьшением концентрации PCl3 или Cl2.
Контрольные вопросы
178. Окисление серы и ее диоксида протекает по уравнениям:
а) S(к) + O2 = SO2(г); б) 2SO2(г) + О2 = 2SO3(г).
Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза?
179. Напишите выражение для константы равновесия гомогенной системы:
N2 + 3H2  2NH3. Как изменится скорость прямой реакции – образования аммиака, если увеличить концентрацию водорода в три раза?
2NH3. Как изменится скорость прямой реакции – образования аммиака, если увеличить концентрацию водорода в три раза?
180. Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были:
 2017-12-14
2017-12-14 1855
1855