Необхідна умова феромагнетизму – наявність постійних (таких, що не залежать від зовнішних магнітних полів) магнітних (спінових чи орбітальних, або тих і інших разом) моментів електронних оболонок атомів (іонів) речовини. Однак при конденсації магніто-активних атомів (іонів) у кристал чи аморфне тіло їхні електронні оболонки часто деформуються таким чином, що кристал чи аморфне тіло уже не має у своїх вузлах постійних магнітних моментів. Найбільшої перебудови при деформації зазнає зовнішний (валентний) шар електронної оболонки. Це зумовлено тим, що хвильові функції валентних електронів у сусідніх атомах в твердому тілі сильно перекриваються, що призводить до колективізації бувших валентних електронів.
У випадку металів вони при цьому утворюють фермі-газ (чи фермі-рідину) електронів провідності, а у неметалічних речовинах – локалізовані спін-насичені зв'язки. Зазвичай, в обох випадках для основного стану (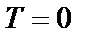 К та
К та 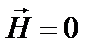 ) намагніченість
) намагніченість 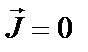 . Експериментальні дослідження виявили на атомних ядрах (Fe, Co, Ni та деяких інших елементах) дуже сильні магнітні поля – до 101…102 Тл, джерелом яких є "деформовані" внутрішні 1 s -, 2 s - та 3 s -шари оболонки іонних остовів. Електрони провідності, підмагнічені через обмінну взаємодію з d - чи f -шарами атомної оболонки, приймають участь у спонтанному намагнічуванні феромагнетика.
. Експериментальні дослідження виявили на атомних ядрах (Fe, Co, Ni та деяких інших елементах) дуже сильні магнітні поля – до 101…102 Тл, джерелом яких є "деформовані" внутрішні 1 s -, 2 s - та 3 s -шари оболонки іонних остовів. Електрони провідності, підмагнічені через обмінну взаємодію з d - чи f -шарами атомної оболонки, приймають участь у спонтанному намагнічуванні феромагнетика.
У випадку, коли феромагнетик складається з атомів перехідних елементів у ньому можливо збереження незалежного від зовнішнього поля магнітного моменту. При цьому можна розрізняти 4 основних типи феромагнітної речовини: 1) металічні речовини (чисті метали, сплави і сполуки) на основі перехідних елементів з недобудованими d -шарами (передусім 3 d -шарами у атомах групи Fe); 2) металічні речовини на основі перехідних f -елементів (передусім рідкоземельних з недобудованим 4 f -шаром); 3) неметалічні сполуки при наявності хоча б одного компонента з перехідних d - чи f -елементів; 4) сильно розбавлені розчини парамагнітних іонів d - чи f -елементів у діамагнітних речовинах.
Як приклад, розглянемо будову атома типового феромагнетика –заліза (рис.2). Цифрами зазначена кількість електронів у шарах оболонок, а стрілки ↑ чи ↓ вказують на напрямки їх спінів.

Рис. 2. Будова атома заліза
Цей атом має 26 електронів. Перша оболонка складається з одного 1 s -шару і має два електрони з протилежно орієнтованими спінами. Друга оболонка складається з двох (2 s - та 2 p -) шарів, містить вісім електронів (два на 2 s -шарі та шість на 2 p -). Третя оболонка недобудована (повинна містити 18 електронів). Вона складається з трьох (3 s -, 3 p - та 3 d -) шарів, і містить 14 електронів (два на 3 s -шарі, шість на 3 p - та шість на 3 d -). Чотири електрона, яких не вистачає у третій оболонці, припадають на 3 d -шар (рис.2). Четверта оболонка також недобудована (може містити 32 електрони), вона складається з одного 4 s -шару, що містить два електрони.
Природа власних магнітних моментів (спінів) електрона є такою, що вони можуть мати тільки одну з двох взаємно протилежних орієнтацій у просторі. На рис.2 це зображено стрілками - ↑ чи - ↓. На кожній оболонці може міститися відповідне (до правил квантування) число електронів, а з урахування принципу Паулі – подвоєна кількість з протилежною орієнтацією спінів (дивись лабораторну работу №1). Повністю забудовані перша і друга оболонки мають однакову кількість електронів з ↑ та ↓ власними магнітними моментами. Ці моменти у кожній оболонці взаємно компенсують один одного. У третій оболонці 3 s - та 3 p - шари нейтральні у магнітному відношенні, а на 3 d - шарі є чотирі нескомпенсовані (↓) магнітні моменти. Магнітні моменти зовнішних (валентних) електронів скомпенсовані. Відповідно, весь атом у цілому має певний магнітний момент за рахунок електронів недобудованого 3 d - шару.
Але наявність нескомпенсованих власних магнітних моментів електронів є лише необхідною умовою феромагнетизму.
Виникнення у всіх зазначених вище речовинах атомного магнітного порядку спричинено так званою обмінною взаємодією у магнетику. Обмінна взаємодія – суто квантомеханічний ефект, її неможливо описати за допомогою класичних моделей.
Електростатична енергія системи буде залежати від взаємної орієнтації спінів – паралельної чи антипаралельної. Встановлено, що при взаємодії багатоелектронних атомів феромагнітних елементів обмінна енергія виявляється меншою при паралельній (↑↑) орієнтації спінів сусідніх атомів або іонів.
Різниця енергій, що відповідаєють паралельній і антипаралельній орієнтації спінів називається обмінною енергією. Обмінна енергія буде визначатись як енергія перевороту заданого спіна у присутності інших. Квантова теорія показує, що вираз для енергії взаємодії 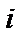 та
та 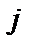 атомів має вигляд
атомів має вигляд
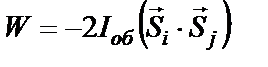 , (4)
, (4)
де 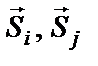 – спіни
– спіни 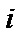 та
та 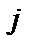 атомів, а
атомів, а 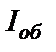 – обмінний інтеграл (параметр речовини, що визначає імовірність обміну електронами між атомами), величина якого залежить від ступеня перекриття електронних оболонок
– обмінний інтеграл (параметр речовини, що визначає імовірність обміну електронами між атомами), величина якого залежить від ступеня перекриття електронних оболонок 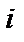 та
та 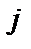 атомів.
атомів.
Стійкий стан системи слід очікувати у випадку коли 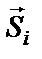 і
і 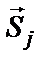 паралельні, а
паралельні, а 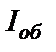 > 0 (згідно (4) значення
> 0 (згідно (4) значення 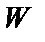 буде мінімальним).
буде мінімальним).
Таким чином, причиною феромагнетизму є обмінна взаємодія, що намагається встановити спіни (а відповідно і магнітні моменти) сусідніх атомів або іонів паралельно один одному. У цьому випадку обмінний інтеграл має додатне значення, а енергія 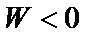 – мінімальною.
– мінімальною.
Наявність у атомі внутрішних недобудованих оболонок (існування нескомпенсованих магнітних моментів електронів) та додатний знак обмінного інтегралу (зумовлює паралельну орієнтацію цих моментів) є необхідною і достатньою умовами виникнення феромагнетизму.
 2017-12-14
2017-12-14 345
345








