| Розчинні основи | Нерозчинні основи |
| 1. Взаємодія із кислотними оксидами | |
| 2KOH + CO2 = K2CO3+ H2O; KOH + CO2 = KHCO3 | –– |
| 2. Взаємодія із кислотами (реакція нейтралізації) | |
| NaOH + HNO3 = NaNO3 + H2O | Cu(OH)2+2HCl = CuCl2 + 2H2O |
| 3. Взаємодія із солями | |
| Ba(OH)2 + K2SO4 = 2KOH + BaSO4↓; 3KOH + Fe(NO3)3 = Fe(OH)3↓+3KNO3 | –– |
| 4. Термічний розклад | |
| –– | Cu(OH)2 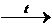 CuO + H2O CuO + H2O
|
Існують гідроксиди, які здатні вступати у взаємодію, і утворювати солі не тільки з кислотами, але й з основами. Такі гідроксиди називаються амфотерні. Прикладом можуть бути Al(OH)3, Zn(OH)2, Cr(OH)3, Be(OH)2, Ge(OH)2, Рb(OH)2. Хімічні властивості амфотерних гідроксидів представлені у табл. 1.5. Явище амфотерності пояснюється тим, що в молекулах амфотерних електролітів (ROH) міцність зв’язку між металом і Оксигеном незначно відрізняється від міцності зв’язку між Оксигеном і Гідрогеном. Дисоціація таких молекул можлива за місцем обох зв’язків:
R+ + OH– ⇄ ROH ⇄ H+ + RO–, де R – метал.
основа кислота
Таблиця 1.5
Хімічні властивості амфотерних гідроксидів
| Основні | Кислотні |
| Zn(OH)2 + 2НCl = ZnCl2 + 2H2O цинк хлорид 2Al(OH)3+3Н2SO4 =Al2(SO4)3 +6H2O алюміній сульфат | при сплавленні: Zn(OH)2 +2КOH = К2ZnO2 + 2H2O; калій цинкат Al(OH)3 + NaOH = NaAlO2 + 2H2O натрій метаалюмінат |
| у розчинах: Al(OH)3 + 3NaOH = Na3[Al(OΗ)6] натрій гексагідроксоалюмінат |
Солі – складні речовини, що складаються з атомів металу та кислотних залишків (табл. 1.6). З точки зору теорії електролітичної дисоціації солі – електроліти, які при дисоціації утворюють катіони металів (або групу NH4+) і аніони кислотних залишків.
Наприклад: NaCl ⇄ Na++Cl–.
Таблиця 1.6
Класифікація солей
| Солі | Приклад | Назва |
| Середні | Na2SO4 | натрій сульфат |
| Кислі | NaHCO3 | натрій гідрогенкарбонат |
| Основні | Fe(OH)2Cl | ферум (ІІІ) дигідроксид хлорид |
| Подвійні | KAl(SO4)2 | алюміній калій дисульфат |
| Змішані | CaOCl2 | кальцій оксид хлорид |
| Комплексні | [Ag(NH3)2]Br | діаміноаргентум бромід |
Середні солі (нормальні) – продукти повного заміщення атомів Гідрогену у кислотах на атоми металу, або гідроксидних груп в основах на кислотні залишки. При дисоціації утворюють катіони металу (або NH4+) і аніони кислотного залишку:
Na2SO4 ⇄ 2Na+ + SO 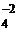 .
.
 2017-12-16
2017-12-16 674
674








