1. Взаємодія з основами (реакція нейтралізації):
H2SO4 + 2KOH = K2SO4 + 2H2O.
2. Взаємодія з основними оксидами:
CuO + 2HNO3 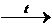 Cu(NO3)2 + H2O.
Cu(NO3)2 + H2O.
3. Взаємодія з металами по механізму окисно-відновних реакцій:
2Al + 6HCl = 2AlCl3 + 3H2↑;
3Cu + 8HNO3 (розведена) = 3Cu(NO3)2 + 2NO↑ + 4H2O.
4. Взаємодія із солями з утворенням газу чи осаду:
H2SO4 + BaCl2 = BaSO4↓ +2HCl;
2HCl + K2CO3 = 2KCl + H2O + CO2↑.
Основи – складні речовини, у яких атоми металів з’єднані з однією чи декількома гідроксидними групами. Кількість гідроксидних груп у молекулі основи означає її кислотність. Класифікація основ представлена в табл. 1.3, а їх хімічні властивості у табл. 1.4.
Таблиця 1.3
Класифікація основ
| За розчинністю у воді | |||
| Розчинні (луги): LiOH, CsOH, NaOH, KOH, RbOH, Ba(OH)2 | Нерозчинні: Fe(OH)3, Сu(OH)2, Аl(OH)3 | ||
| За кислотністю | |||
| Однокислотні: LiOH, NaOH, KOH, RbOH, CsOH, | Двокислотні: Ca(OH)2, Ba(OH)2, Cu(OH)2 | Трикислотні: Аl(OH)3, Fe(OH)3 | |
Одержання нерозчинних основ
Взаємодія розчинів солей і лугів:
Al2(SO4)3 + 6NaOH = 2Al(OH)3↓ + 3Na2SO4.
Одержання розчинних основ
1. Взаємодія активних металів (лужних і лужноземельних) з водою: 2Na + 2H2O = 2NaOH + H2↑;
Ca + 2H2O = Ca(OH)2 + H2↑.
2. Взаємодія оксидів активних металів з водою:
BaO + H2O = Ba(OH)2.
3. Електроліз водних розчинів солей:
2NaCl + 2H2O = 2NaOH + H2↑ + Cl2↑.
Таблиця 1.4
 2017-12-16
2017-12-16 629
629








