Свойства
Все элементы группы 8 содержат 8 электронов на своих валентных оболочках. Два элемента группы — рутений и осмий — относятся к семейству платиновых металлов. Как и в других группах, члены 8 группы элементов проявляют закономерности электронной конфигурации, особенно внешних оболочек, хотя, как ни странно, рутений не следует этому тренду. Тем не менее, у элементов этой группы тоже проявляется сходство физических свойств и химического поведения
Ответ на вопрос №22
1) Для качественного обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe3+ с тиоцианат-ионамиSCN−. При взаимодействии ионов Fe3+ с анионами SCN− образуется смесь ярко-красных роданидных комплексов железа [Fe(SCN)]2+, [Fe(SCN)2]+, Fe(SCN)3, [Fe(SCN)4]-.[19] Состав смеси (а значит, и интенсивность её окраски) зависит от различных факторов, поэтому для точного качественного определения железа этот метод неприменим. Другим качественным реактивом на ионы Fe3+ служитгексацианоферрат(II) калия K4[Fe(CN)6] (жёлтая кровяная соль). При взаимодействии ионов Fe3+ и [Fe(CN)6]4− выпадает ярко-синий осадокберлинской лазури:
4K4[Fe(CN)6] + 4Fe3+ → 4KFeIII[FeII(CN)6]↓ + 12K+.
|
|
|
2) Для количественного определения железа (II) в растворе используют фенантролин Phen, образующий с железом (II) красный комплекс FePhen3 (максимум светопоглощения — 520 нм) в широком диапазоне рН (4-9)
Ответ на вопрос №20
1) МnO легко окисляется с образованием MnO2
2) При взаимодействии с сильными окислителями диоксид марганца Мn4+ окисляется до соединения Mn6+:
3MnO2 + KClO3 + 6KOH → 3K2MnO4 + KCl + 3H2O.
3) При взаимодействие с хлором Mn6+ окисляется до Mn7+:

Ответ на вопрос № 26
1) Состояние химического равновесия обратимых процессов количественно характеризуется константой равновесия. Так, для обратимой реакции, которую в общем виде можно записать как
согласно закону действующих масс, скорости прямой реакции v1 и обратной v2 соответственно запишутся следующим образом:
В момент достижения состояния химического равновесия скорости
где К -- константа равновесия, представляющая собой отношение констант скорости прямой и обратной реакций.
В правой части первого уравнения стоят те концентрации взаимодействующих веществ, которые устанавливаются при равновесии, -- равновесные концентрации.
Второе уравнение представляет собой математическое выражение закона действующих масс при химическом равновесии.
Этот закон является одним из наиболее важных в химии. Исходя из кинетического уравнения любой химической реакции, можно сразу же записать отношение, связывающее равновесные концентрации реагирующих веществ и продуктов реакции. Если определить константу К экспериментально, измеряя равновесные концентрации всех веществ при данной температуре, то полученное значение можно использовать в расчетах для других случаев равновесия при той же температуре.
|
|
|
Численное значение константы равновесия характеризует тенденцию к осуществлению реакции или, другими словами, характеризует выход данной реакции. Так, при К >> 1 выход реакции велик, так как при этом
Понятно, что при К << 1 выход реакции мал.
2) K4[Fe(CN)6] = 4K+ + [Fe(CN)6]4- (первичная диссоциация)
[ Fe(CN)6] 4- = Fe2+ + 6 CN- (Вторичная диссоциация)
3) Комплекс K3[Fe(CN)6] диссоциирует двухступенчато:
сначала происходит первичная диссоциация:
K3[Fe(CN)6]=3К+ +[Fe(CN)6]3−
но вторичная происходит за 6 этапов:
[Fe(CN)6]3− + Н2О = [Fe(CN)5(Н2О)]2− + CN−
[Fe(CN)5(Н2О)]2− + Н2О = [Fe(CN)4(Н2О)2]− + CN−
[Fe(CN)4(Н2О)2]− + Н2О = [Fe(CN)3(Н2О)3] + CN−
[Fe(CN)3(Н2О)3] + Н2О = [Fe(CN)2(Н2О)4]+ + CN−
[Fe(CN)2(Н2О)4]+ + Н2О = [Fe(CN)(Н2О)5]2+ + CN−
[Fe(CN)(Н2О)5]2+ + Н2О = [Fe(Н2О)6]3+ + CN−
Ответ на вопрос №23
При подкислении раствора какого-нибудь хромата, например, хромата калия K2CrO4, чисто-желтая окраска раствора сменяется на оранжевую вследствие перехода ионов CrO2-4 в ионы Cr2O2-7. Из полученного раствора может быть выделена соль двухромовой кислоты - двухромат калия K2Cr2O7 - в виде оранжево-красных кристаллов. Реакция превращения хромата в дихромат выражается уравнением:
2CrO2-4+2H+-Cr2O2-7+H2O
Реакция обратима. Это значит, что при растворении дихромата в воде всегда образуется некоторое, хотя и незначительное, количество ионов Н+ и CrO2-4; поэтому раствор дихромата имеет, кислую реакцию. Если к раствору дихромата прибавлять щелочь, то гидроксид-ионы будут связывать находящиеся в растворе ионы водорода, равновесие смещается влево и в результате дихромат превращается в хромат. Таким образом, в присутствии избытка гидроксид-ионов в растворе практически существуют только ионы CrO2-4, т. е. хромат, а при избытке ионов водорода - ионы Cr2O2-7, т. е. дихромат.
Хроматы щелочных металлов получаются путём окисления соединения хрома (III) в присутствии щелочи. Так, при действии брома на раствор хромита калия образуется хромат калия по уравнению:
2K3[Cr(OH)6]+3Br2+4KOH>2K2CrO4+6KBr+8H2O
О происходящем окислении можно судить по тому, что изумрудно-зелёная окраска раствора хромита переходит в ярко-желтую.
Хроматы могут быть получены также сплавлением Cr2O3 со щелочью в присутствии какого-нибудь окислителя, например хлората калия:
Cr2O3+4KOH+KClO3>2K2CrO4+KCl+2H2O
Хроматы и дихроматы - сильные окислительные. Поэтому ими широко пользуются для окисления различных веществ. Окисление производится в кислом растворе и обычно сопровождается резким изменением окраски (дихроматы окрашены в оранжевый цвет, а соли хромата (III) - в зелёный или зеленовато-фиолетовый).
Мы видели, что в кислых и в щелочных растворах соединения хрома (III) и хрома (VI) существует в разных формах: в кислой среде в виде ионов Cr3+ или Cr2O2-7, а в щелочной - в виде ионов [Cr(OH)6]3- или CrO2-4. Поэтому взаимопревращение соединений хрома (III) и хрома (VI) протекает по-разному в зависимости от реакции раствора. В кислой среде устанавливается равновесие
Cr2O2-7+14H++6e?-2Cr3++7H2O
а в щелочной
[Cr(OH)6]3-+2OH--CrO2-4+4H2O+3e?
Однако и в кислой, и в щелочной среде окисления хрома (III)приводит к уменьшению pH раствора; обратный же процесс - восстановление хрома (VI) - сопровождается увеличением pH. Поэтому, в соответствии с принципом Ле Шарля, при повышении кислотной среды равновесие смещается в направлении восстановления хрома (VI), а при уменьшении кислотности - в направлении окисления хрома (III). Иначе говоря, окислительные свойства соединений хрома (VI) наиболее сильно выражены в кислой среде, а восстановительные свойства соединений хрома (III) - в щелочной. Именно поэтому, как указывалось выше, окисление хромитов в хроматы осуществляют в присутствии щелочи, а соединения хрома (VI) применяют в качестве окислителей в кислых растворах.
|
|
|
Приведём несколько примеров окислительно-восстановительных реакций, протекающих при участии дихроматов.
Ответ на вопрос №24
Рассмотрим позиций строение двух комплексов кобальта(III): ионов гексааминокобальта(III) [Co(NH3)6]3+ и гексафторокобальтата(III) [CoF6]3− (Рис. 2.1).
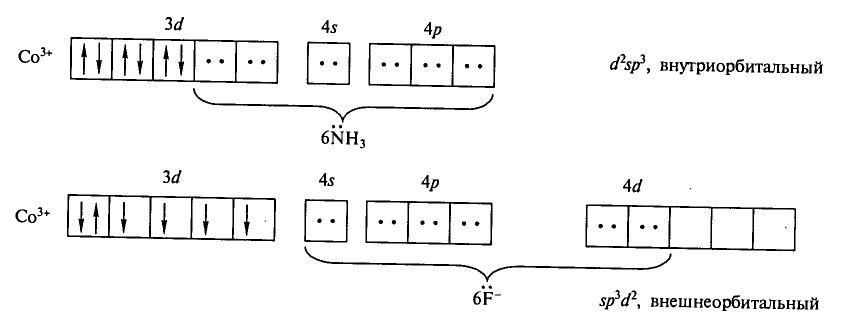
Рис. 2.1. Строение ионов [Co(NH3)6]3+ и [CoF6]3− по МВС
Электронная конфигурация свободного иона Со3+: 3d64s04p04d0. Орбитали иона кобальта, участвующие в образовании связи с ионами F−, гибридизуются с образоваинем sp3d2-гибридных орбиталей (внешнеорбитальный комплекс), что и определяет октаэдрическую конфигурацию комплексного иона [CoF6]3−.
В ионе [Co(NH3)6]3+ реализуется иное распределение электронов по орбиталям – все электроны кобальта спарены. Комплекс также имеет октаэдрическую структуру, но иной тип гибридизации – d2sp3 (внутриорбитальный комплекс). Выбрать одну из этих двух возможных конфигураций можно только, если известны магнитные свойства комплекса. Ион [Co(NH3)6]3+ диамагнитен, все электроны спарены, а ион [CoF6]3− парамагнитен. Определить магнитные свойства комплекса с точки зрения метода валентных связей невозможно, также как и цветность комплекса, и его внутри- или внешнеорбитальность. Для этого следует прибегнуть к другим методам [1].
2) ОВР: 4[Co(H2O)6]3+(водн.) + 2H2O(ж.) ⇄ [Co(H2O)6]2+(водн.) + 4H+(водн.) + O2(г.)
Ответ на вопрос №25
Цианид-ион резко выделяется из числа других лигандов благодаря высокой устойчивости его комплексов с некоторыми металлами. Из лигандов, занимающих одно координационное место, только цианид-ион способен при взаимодействии с этими металлами конкурировать с ЭДТА и вытеснять ее из комплексов с ними. На использовании этого свойства основано комплексонометрическое определение цианид-ионов.
4Au + 8KCN + 2H2O + O2 → 4K[Au(CN)2] + 4 KOH
2K[Au(CN)2] + Zn = 2Au + K2[Zn(CN)4]
Ответ на вопрос №19
Выразим равновесную концентрацию [Fe3+] через константу нестойкости комплекса (27):
 .
.
и подставим ее в уравнение Нернста для данной окислительно-восстановительной системы (26):
|
|
|
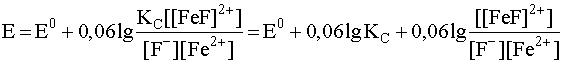 .
.
Два первых слагаемых в этом выражении представляют собой сумму постоянных величин, которая, естественно, тоже есть величина постоянная, которую обозначим Е01 и которая есть новое значение стандартного электродного потенциала окислительно-восстановительной пары Fe3+/Fe2+ с учетом комплексообразования по окислителю:
 (28)
(28)
Тогда уравнение Нернста примет вид:
 (29)
(29)
Из рассмотрения уравнений (28) и (29) следуют важные выводы:
Если при добавлении лиганда к окислительно-восстановительной системе комплексообразованию подвергается только окислитель, то потенциал этой системы уменьшается, а значит, уменьшается сила окислителя этой пары и увеличивается сила ее восстановителя. Уменьшение потенциала вытекает из того, что для достаточно устойчивых комплексов KC << 1, следовательно, lgKC есть величина отрицательная, поэтому Е01 < Е0.
Уменьшение потенциала окислительно-восстановительной системы будет тем заметнее, чем более устойчивый комплекс образует добавляемый лиганд с окислителем этой системы, то есть чем меньше численное значение константы нестойкости возникающего комплекса.
Дополнительное уменьшение потенциала окислительно-восстановительной системы вызывается введением в раствор избытка лиганда, так как при этом с ростом концентрации лиганда дробь под знаком логарифма в выражении (29) становится все меньше и меньше.
Стандартный электродный потенциал пары [Fe(CN)6]3–/[Fe(CN)6]4– равен +0,54В, а для пары, состоящей из свободных катионов Fe3+/Fe2+ он составляет 0,77 В. Обращает на себя внимание то, что в данном случае разница этих двух стандартных потенциалов значительно меньше, чем в случае разобранных нами цианидных комплексов кобальта. Это и понятно: если для кобальта константы нестойкости комплексов отличаются друг от друга почти на 45 (!) порядков (10–64 и 10–19,1), то для гексацианоферратов эта разница составляет "всего лишь" 7 порядков.
Ответ на вопрос №18
комплексной соли гексацианоферрате(III) калия K3[Fe(CN)6] координационное число иона Fe3+ равно 6,
Окси́д желе́за(III) — сложное неорганическое вещество, соединение железа и кислорода схимической формулой Fe2O3. 
фторид железа (III), также известный как фторид железа, это неорганическое соединение. Она существует в безводной форме (формула FeF3), а также два гидратированные формы (как формула FeF3 · 3H2O). Он производится на коммерческой основе в основном для лабораторных работ и не так полезна, как соответствующие соединения железа (III) хлорид. Безводный железа (III) фторид белым цветом, а гидратированные формы светло-розовый 
Хлорид железа(III), хлорное железо FeCl3 — средняя соль трёхвалентного железа и соляной кислоты.

Ответ на вопрос №17
K4[Fe(CN)6]
K3[Fe(CN)6]
Ответ на вопрос №15
1) Растворы щелочей разлагают сульфат железа(III), продукты реакции зависят от концентрации щёлочи:


А сульфат железа(II)не реагирует
2) ОВР:
2FeSO4 → Fe2O3 + SO2↑ + SO3↑

Ответ на вопрос №5
Не существует о-элементы
Ответ на вопрос №14
При взаимодействии с сильными окислителями диоксид марганца окисляется до соединений Mn7+и Mn6+:
3MnO2 + KClO3 + 6KOH → 3K2MnO4 + KCl + 3H2O.
Из распространённого MnO2 его получают через частичное восстановление при температурах 700-900 °C водородом или угарным газом.
Ответ на вопрос № 13
Как вы уже знаете, в кислотной, нейтральной или щелочной среде ОВР одних и тех же окислителей и восстановителей часто протекают с образованием различных продуктов реакции. Рассмотрим подробнее окислительно-восстановительные свойства соединений марганца, проявляемые ими в разных условиях.
При проведении ОВР для создания в растворе кислотной среды обычно используют серную кислоту. Азотную кислоту используют крайне редко, так как она сама является сильным окислителем; соляную, бромоводородную и йодоводородную кислоты не используют из-за их способности к окислению. Щелочная среда создается добавлением в раствор гидроксидов натрия или калия.
Для марганца известны соединения, в которых он проявляет все возможные степени окисления: от нуля до +VII. В ОВР, протекающих в растворах, чаще всего участвуют соединения марганца в степенях окисления +II, +IV, +VII и, отчасти, +VI. Соединения марганца(II) проявляют слабо выраженные восстановительные свойства. Соединения, содержащие марганец в степенях окисления +IV, +VI и +VII, – более или менее сильные окислители. Наиболее сильными окислителями являются соединения марганца в степени окисления +VII. Металлический марганец – довольно активный восстановитель.
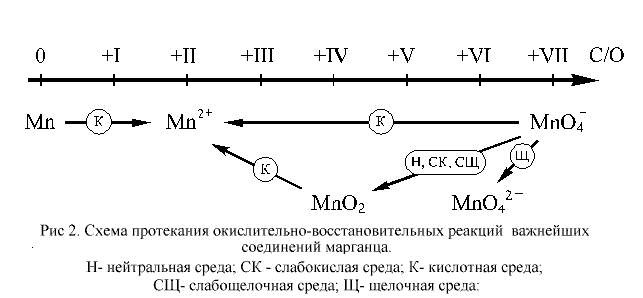
Как видно из приведенной на этом рисунке схемы, перманганат-ион, входящий в состав самого популярного в лабораторной практике окислителя, KMnO4, в различных средах восстанавливается по-разному. В наибольшей степени окислительные свойства перманганат калия проявляет в кислотной среде, в несколько меньшей – в нейтральной и в наименьшей степени – в щелочной. Рассмотрим эти случаи на конкретных примерах.
Пример 1. Составьте уравнение реакции, протекающей при пропускании диоксида серы через подкисленный серной кислотой раствор перманганата калия.
Для составления уравнения воспользуемся методом электронно-ионного баланса.
1 и 2. 
При составлении уравнений ОВР наличием в растворе гидросульфатных ионов обычно пренебрегают. (Наличием ионов HSO4  нельзя пренебрегать при составлении уравнений ОВР типа взаимодействия концентрированной H2SO4 с NaBr (среди прочего образуется NaHSO4), но уравнения этих реакций составляют, используя метод электронного балланса.)
нельзя пренебрегать при составлении уравнений ОВР типа взаимодействия концентрированной H2SO4 с NaBr (среди прочего образуется NaHSO4), но уравнения этих реакций составляют, используя метод электронного балланса.)
3 – 5. В кислотной среде ион MnO4  восстанавливается до иона Mn2
восстанавливается до иона Mn2  . " Лишние" атомы кислорода(–II) свяжутся ионами H3O
. " Лишние" атомы кислорода(–II) свяжутся ионами H3O  с образованием воды. Диоксид серы в присутствии сильных окислителей проявляет восстановительные свойства. При этом сера(IV) окисляется до ближайшей устойчивой степени окисления, то есть, до степени окисления +VI. Нетрудно убедиться, что единственной частицей, содержащей серу(VI) и устойчивой в водном растворе, будет сульфатный ион (действительно, SO3 в водном растворе образоваться не может, так как реагирует с водой, давая H2SO4; молекулы серной кислоты (сильная кислота) в разбавленном водном растворе также не модут образоваться). Недостающие атомы кислорода(–II) могут быть " позаимствованы" у молекул воды с образованием ионов оксония, что в кислотной среде вполне допустимо
с образованием воды. Диоксид серы в присутствии сильных окислителей проявляет восстановительные свойства. При этом сера(IV) окисляется до ближайшей устойчивой степени окисления, то есть, до степени окисления +VI. Нетрудно убедиться, что единственной частицей, содержащей серу(VI) и устойчивой в водном растворе, будет сульфатный ион (действительно, SO3 в водном растворе образоваться не может, так как реагирует с водой, давая H2SO4; молекулы серной кислоты (сильная кислота) в разбавленном водном растворе также не модут образоваться). Недостающие атомы кислорода(–II) могут быть " позаимствованы" у молекул воды с образованием ионов оксония, что в кислотной среде вполне допустимо
MnO4  + 8H3O + 8H3O  + 5e– = Mn2 + 5e– = Mn2  + 12H2O + 12H2O | |
SO2 + 6H2O – 2e– = SO42  + 4H3O + 4H3O  |
6. После умножения каждого из уравнений полуреакций на соответствующие множители, сложения уравнений и приведения подобных членов получаем ионное уравнение.
2MnO4  + 5SO2 + 6H2O = 2Mn2
+ 5SO2 + 6H2O = 2Mn2  + 5SO42
+ 5SO42  + 4H3O
+ 4H3O 
7. Добавив в левой части уравнения необходимое количество противоионов и не забывая о них при написании формул продуктов реакции, запишем молекулярное уравнение:
2KMnO4 + 5SO2 + 2H2O = 2MnSO4 + 2H2SO4 + K2SO4
Из уравнения видно, что серная кислота, которая по смыслу задания должна была вступить в реакцию, в действительности в реакцию не вступает, а, наоборот, в процессе реакции выделяется, то есть добавлена в раствор только как средообразователь. Но это скорее исключение, чем правило. Убедимся в этом на другом примере.
Пример 2. Составьте уравнение реакции, протекающей при добавлении раствора азотистой кислоты к подкисленному раствору перманганата калия.
1 – 2. 
3 – 5. Азотистая кислота – кислота слабая, поэтому в растворе она присутствует в основном в виде молекул. Она легко окисляется при добавлении сильных окислителей. При этом степень окисления азота повышается до ближайшей устойчивой, то есть до +V (устойчивый в газовой фазе диоксид азота в воде диспропорционирует). Единственная частица, содержащая атом азота(V) и устойчивая в водном растворе – нитрат-ион.
MnO4  + 8H3O+ 5e– = Mn2 + 8H3O+ 5e– = Mn2  + 12H2O + 12H2O | |
HNO2 + 4H2O – 2e– = NO3  + 3H3O+ + 3H3O+ |
6. Ионное уравнение
2MnO4  + H3O
+ H3O  + 5HNO2 = 2Mn2
+ 5HNO2 = 2Mn2  + 4H2O + 5NO3
+ 4H2O + 5NO3 
7. При переходе от ионного уравнения к молекулярному первое приходится удваивать, так как одна молекула серной кислоты образует два иона оксония.
4KMnO4p + H2SO4p + 10HNO2p = MnSO4p + 3Mn(NO3)2p + 6H2O + 4KNO3p
Это уравнение можно записать и по-другому:
4KMnO4p + H2SO4p + 10HNO2p = 4Mn(NO3)2p + 6H2O + 2KNO3p + K2SO4p
Оба уравнения правильные, так как отражают процесс, протекающий в растворе. При удалении воды кристаллизоваться будут все четыре соли [MnSO4, Mn(NO3)2, K2SO4, KNO3] причем в соотношении, определяемом их растворимостью, а не коэффициентами в каком-либо из уравнений.
Пример 3. Составьте уравнение реакции, протекающей при сливании раствора перманганата калия с раствором аммиака.
1 – 2. 
3 – 5. Аммиак – слабое основание, поэтому среда в его водном растворе слабощелочная, и перманганат-ион в этих условиях при восстановлении превращается в диоксид марганца, выпадающий из раствора в виде бурого осадка. В нейтральной и щелочной среде очень мало ионов оксония, поэтому для связывания " лишних" атомов кислорода(–II) могут быть использованы лишь молекулы воды. Каждая молекула воды, присоединяя один атом кислорода(–II), превращается в два гидроксид-иона. Аммиак в этих условиях окисляется до азота (ближайшая устойчивая степень окисления – ноль).
MnO4  + 2H2O + 3e– = MnO2 + 4OH + 2H2O + 3e– = MnO2 + 4OH  | ||
2NH3 + 6H2O – 6e– = N2 + 6H3O  |
6. 2MnO4  + 10H2O + 2NH3 = 2MnO2 + 8OH
+ 10H2O + 2NH3 = 2MnO2 + 8OH  + N2
+ N2  + 6H3O
+ 6H3O 
Так как в одной из полуреакций образуются гидроксид-ионы, а в другой – " ионы водорода", что вполне допустимо в нейтральной (или близкой к ней) среде, перед приведением подобных членов в ионном уравнении необходимо учесть, что эти ионы одновременно в водном растворе существовать не могут (пройдет реакция нейтрализации).
2MnO4  + 4H2O + 2NH3 = 2MnO2 + 2OH
+ 4H2O + 2NH3 = 2MnO2 + 2OH  + N2 + 6H2O
+ N2 + 6H2O
После приведения подобных членов получаем ионное уравнение:
2MnO4  + 2NH3 = 2MnO2 + 2OH
+ 2NH3 = 2MnO2 + 2OH  + N2
+ N2  + 2H2O
+ 2H2O
7. 2KMnO4 + 2NH3 = 2MnO2 + 2KOH + N2  + 2H2O
+ 2H2O
Пример 4. Составить уравнение реакции, протекающей при сливании раствора перманганата калия с раствором сульфита калия в присутствии гидроксида калия.

MnO4  + e– = MnO42 + e– = MnO42  | |
SO32  + 2OH + 2OH  – 2e– = SO42 – 2e– = SO42  + H2O + H2O |
2MnO4  + SO32
+ SO32  + 2OH
+ 2OH  = 2MnO42
= 2MnO42  + SO42
+ SO42  + H2O
+ H2O
2KMnO4 + K2SO3 + 2KOH = 2K2MnO4 + K2SO4 + H2O
Источником " недостающего" атома кислорода(–II) в щелочной среде могут быть только два гидроксидных иона, при попытке использовать молекулу воды или один гидроксидный ион образуются свободные ионы оксония, что в щелочной среде невозможно.
Диоксид марганца MnO2 в кислотной среде, как вы уже знаете, также проявляет свойства сильного окислителя, например, окисляет не только хлорид-ион до хлора, но и нитрит-ион до нитрат-иона, йодид-ион до йода и т. д. В свою очередь сам диоксид марганца получается при взаимодействии перманганата калия с растворами солей марганца(II) по реакции конмутации
2MnO4  + 3Mn2
+ 3Mn2  + 6H2O = 5MnO2 + 4H3O
+ 6H2O = 5MnO2 + 4H3O 
А устойчивый только в сильно щелочных растворах манганат калия K2MnO4 уже при незначительном подкислении и даже при разбавлении раствора водой диспропорционирует:
3MnO42  + 2H2O = 2MnO4
+ 2H2O = 2MnO4  + MnO2 + 4OH
+ MnO2 + 4OH 
Очень сильным окислителем является оксид марганца(VII). Это кислотный оксид (при обычных условиях жидкость), активно реагирующий с водой
Mn2O7 + H2O = 2HMnO4
и поглощающий ее из воздуха. Он легко окисляет аммиак (до N2), сероводород (до SO2), сульфиды (до сульфатов), монооксид углерода и органические вещества (до CO2), сам при этом восстанавливаясь до MnO2.
Ответ на вопрос №11
Реакции окисления - восстановления могут протекать в различных средах: в кислой, нейтральной и щелочной. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления. Обычно для создания в растворе кислой среды используют серную кислоту. Для создания щелочной среды применяются растворы гидроксидов калия или натрия. Рассмотрим примеры протекания реакции между сульфитом натрия Na2SO4 (восстановитель) c перманганатом калия KMnO4(окислитель).
Ответ на вопрос №10
Общая характеристика комплексных соединений хрома (III)
Степень окисления +3 наиболее характерна для хрома. Для этого состояния характерно большое число кинетически устойчивых комплексов. Именно из-за такой кинетической инертности удалось выделить в твердом состоянии большое число комплексных соединений хрома, которые в растворе остаются неизменными в течение длительного времени.
Наличие трех неспаренных электронов обусловливает парамагнетизм соединений Cr (III), большинство из которых интенсивно окрашены. [1]
В литературе описано множество комплексов трехвалентного хрома. Во всех без исключения комплексах CrIII имеет координационное число (КЧ) шесть.
Ярко выраженная способность трехвалентного хрома к образованию комплексных соединений особенно отчетливо проявляется в его различных комплексных продуктов присоединения аммиака.
В соответствии со своим КЧ 6 ион хрома (III) может координационно связать шесть молекул аммиака. При этом образуется комплексный ион [Cr (NH3) 6] 3+, заряд которого совпадает с зарядом хрома, фигурирующего в качестве центрального атома, поскольку молекулы аммиака не заряжены.
Вследствие прочного связывания молекул аммиака при растворении в воде соединений, содержащих комплекс [Cr (NH3) 6] 3+, не происходит моментального распада комплекса - он существует в растворе как ион и лишь постепенно происходит замещение аммиака молекулами воды.
[Cr (NH3) 6] 3+  [Cr (H2O) 2 (NH3) 4] 3+
[Cr (H2O) 2 (NH3) 4] 3+  [Cr (H2O) 4 (NH3) 2] 3+
[Cr (H2O) 4 (NH3) 2] 3+  [Cr (H2O) 6] 3+
[Cr (H2O) 6] 3+
Исследования поведения гексаакваиона хрома (III) в растворах соляной кислоты во времени, позволили установить, что равновесие в системе Cr3+-H2O-Cl - [2] устанавливается примерно 3,5 месяца.
Комплексообразование в этих растворах протекает последовательно по ступеням во времени:
[Cr (H2O) 6] 3+ 
Спектры поглощения растворов показывают, что даже в самом концентрированном относительно соляной кислоты растворе (12 н) комплексообразование заканчивается на третьей ступени.
Таким образом, реакция внедрения ионов хлора в координационную сферу комплекса протекает крайне медленно, инертными являются не только гексааквокомплекс, но и смешанные аквахлориды хрома (III) по отношению к реакции обмена молекул воды на хлорид-ионы, происходящего в процессе образования комплексов; инертность смешанных комплексов уменьшается с увеличением числа ионов хлора в координационной сфере комплекса.
Процессы акватации транс- и цис- дихлородиэтилендиамминхромихлорида:
[Cr (en) 2Cl2] +  [Cr (en) 2Cl (H2O)] 2+
[Cr (en) 2Cl (H2O)] 2+ 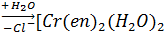 ] 3++Cl-
] 3++Cl-
Гидроксил может образоваться из молекулы воды, содержащейся во внутренней координационной сфере, в результате отщепления протона. Вероятность образования гидроксила во внутренней координационной сфере растет при повышении рН и уменьшается при понижении рН. Поэтому прибавление кислоты понижает вероятность образования гидроксила во внутренней координационной сфере и, следовательно замедляет процессы акватации именно тех ацидокомплексов, во внутренней координационной сфере которых содержится молекула воды. Если же во внутренней координационной сфере нет молекулы воды, то такого рода влияние величины рН исключается.
Достаточно широко исследовано влияние ионов Cr2+ на процессы акватации ацидохроми-комплексов. Оказалось, что ионы Cr2+ катализируют процессы акватации изученных ацидохроми-комплексов.
Например, каталитический процесс акватации транс-дихлородиаминхроми-хлорида протекает следующим образом. Вероятно, катализатор образует промежуточный комплекс, в котором связь между атомами Cr2+ и Cr3+ осуществляется через ион хлора:
Транс - [CrIII (en) 2Cl2] + + [CrII (H2O) 6] 2+  [Cl (en) 2CrIII, II - Cl - CrII, III (H2O) 5] 3+.
[Cl (en) 2CrIII, II - Cl - CrII, III (H2O) 5] 3+.
После передачи электрона может произойти распад комплекса. Наиболее вероятен распад по связи CrII - Cl:
[Cl (en) 2CrII-Cl-CrIII (H2O) 5] 3+ → [Cl (en) 2CrII (H2O)] + + [ClCrIII (H2O) 5] 2+,
освободившееся координационное место у CrII заняла молекула воды.
Замена во внутренней сфере одних лигандов другими часто сопровождается отчетливым изменением окраски комплекса.
Ион [Cr (H2O) 6] 3+ поглощает свет в красной, голубой частях видимого спектра, а также в ближайшей ультрафиолетовой области, поэтому имеет фиолетовую окраску, вызванную наложением двух дополнительных цветов.
Известно много комплексных анионов состава [CrX6] 3-, где Х - монодентатный лиганд типа F-, Cl-, NCS-, CN-, или часть полидентатного аниона типа оксалата (C2O42-). Существует, разумеется, множество смешанных ацидоамино - и и ацидоакво - комплексов.
Проведем некоторую их классификацию[3]:
1) [Cr (NH3) 6] 3+, [Cr (NH3) 5 (H2O)] 3+, [Cr (NH3) 4 (H2O) 2] 3+, [Cr (NH3) 3 (H2O) 3] 3+, [Cr (NH3) 2 (H2O) 4] 3+, [Cr (H2O) 6] 3+
2) [Cr (NH3) 5Cl] 2+, [Cr (NH3) 4 (H2O) Cl] 2+, [Cr (NH3) 3 (H2O) 2Cl] 2+, [Cr (NH3) 2 (H2O) 3Cl] 2+, [Cr (H2O) 5Cl] 2+
3) [Cr (NH3) 4 (SCN) 2] +, [Cr (NH3) 3 (H2O) (SCN) 2] +, [Cr (NH3) 2 (H2O) 2 (SCN) 2] +, [Cr (H2O) 4 (SCN) 2] +
4) [Cr (NH3) 3 (OH) 3], [Cr (NH3) 2 (H2O) (OH) 3], [Cr (H2O) 3 (OH) 3]
5) [Cr (NH3) 2 (SCN) 4] -, [Cr (H2O) 2 (SCN) 4] -
6) [Cr (H2O) (SCN) 5] 2-
7) [CrCl6] 3-
Ответ на вопрос №8
Амфоте́рность (от др.-греч. (ἀμφότεροι — «двойственный», «обоюдный») — способность некоторых соединений проявлять в зависимости от условий как кислотные, так и осно́вные свойства.
Понятие амфоте́рность как характеристика двойственного поведения вещества было введено в 1814 г. Ж. Гей-Люссаком и Л. Тенаром. А. Ганч в рамках общей химической теории кислотно-основных взаимодействий (1917-1927 гг.) определил амфоте́рность как «способность некоторых соединений проявлять как кислотные, так и основные свойства в зависимости от условий и природы реагентов, участвующих в кислотно-основном взаимодействии, особенно в зависимости от свойств растворителя».
Амфотерны гидроксиды таких элементов главных подгрупп, как бор, алюминий, галлий, мышьяк, сурьма, селен и др., таких элементов побочных подгрупп как хром, цинк, молибден, вольфрам и многих других. Обычно в химическом поведении гидроксидов преобладает или кислотный, или основный характер
3. Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями. Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов[3]. Например, для соединений хрома (III) известны реакции[5]:
Cr(OH3) (тв) + 3HCl (р-р)  CrCl3 (р-р) + 3H2O
CrCl3 (р-р) + 3H2O
Cr(OH3) (тв) + NaOH (р-р) + 2H2O  Na[Cr(OH)4(H2O)2] (р-р)
Na[Cr(OH)4(H2O)2] (р-р)
Cr2O3 (тв) + 6HCl (р-р)  2CrCl3 (р-р) + 3H2O
2CrCl3 (р-р) + 3H2O
Cr2O3 (тв) + Na2CO3 (плавл)  2NaCrO2 + CO2 (газ)
2NaCrO2 + CO2 (газ)
Не соответствуют действительности традиционные представления о проявлении амфотерности гидроксидов как диссоциации по кислотному и основному типам[2]. В общем виде амфотерное поведение нерастворимых гидроксидов хрома (III), алюминия, цинка может описано как реакции ионного обмена ионов среды с лигандами H2O и OH–. Например, для Al(OH3) ионные равновесия могут быть записаны следующим образом:
[Al(OH)3(H2O)3] + 3H3O+  Al(H2O)63+ + 3H2O (в кислой среде)
Al(H2O)63+ + 3H2O (в кислой среде)
[Al(OH)3(H2O)3] + 3OH-  Al(OH)63-. (в щелочной среде)
Al(OH)63-. (в щелочной среде)
4. В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного ианионного типа[6]. Например, для цинка: ZnCl2, [Zn(H2O)4]SO4 (катионные) и Na2ZnO2, Na2(Zn(OH)4) (анионные).
Ответ на вопрос №9
Подгру́ппа ма́рганца — химические элементы 7-й группы периодической таблицы химических элементов (поустаревшей классификации — элементы побочной подгруппы VII группы)[. В группу входят переходные металлы марганец Mn, технеций Tc и рений Re. На основании электронной конфигурации атома к этой же группе относится и элемент борий Bh, искусственно синтезированный в 1976 г. группой Юрия Оганесяна изОбъединённого института ядерных исследований в Дубне.
Как и в других группах, члены этого семейства элементов проявляют закономерности электронной конфигурации, особенно внешних оболочек, в результате проявляется сходство физических свойств и химического поведения:
Элементы группы 7 имеют по 7 валентных электронов. Все они являются серебристо-белыми тугоплавкими металлами. В ряду Mn — Tc — Re химическая активность понижается. Электропроводность рения приблизительно в 4 раза меньше, чем вольфрама. Металл этот представляет собой прекрасный материал для изготовления нитей электроламп, более прочных и долговечных, чем обычные вольфрамовые. На воздухе компактный металлический марганец покрывается тончайшей пленкой окисла, которая предохраняет его от дальнейшего окисления даже при нагревании. Напротив, в мелко раздробленном состоянии он окисляется довольно легко
Ответ на вопрос №8а
1) К раствору соли кобальта (II) прильем сначала немного раствора аммиака NH4OH, а затем его избыток.
Наблюдения: NH4OH - бесцветный. В результате реакции образуется синий раствор [Co(NH3)6](OH)2
Co(OH)Cl + 7NH4OH = [Co(NH3)6](OH)2 + NH4Cl + 6H2O.
2) К раствору соли никеля (II) прильем несколько капель раствора аммиака, а затем его избыток.
Наблюдения: NiSO4 - салатовый,
а) образуется осадок
б) раствор становится темно-синим
NiSO4 + 2NH4OH = Ni(OH)2↓ (салатовый) + (NH4)2SO4
Ni(OH)2 + 6NH4OH = [Ni(NH3)6]2+ + 2OH- + 6H2O
Ответ на вопрос №
.
[2] Cr-H2O-Cl – условное обозначение растворов, содержащих гидратированные ионы трехвалентного хрома и хлорид - ионы.
 2017-12-16
2017-12-16 4651
4651