Примерами полифункциональных конъюгатов являются комплекс синтазы жирных кислот (рис. 4.1.5) и КАД – комплекс, объединяющий первые три энзиматические активности. участвующие в метаболизме пиримидинов.
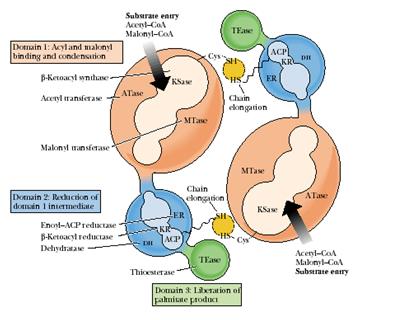
Рис.4.1.5. Комплекс синтазы жирных кислот млекопитающих
Каждая субъединица этого конъюгата включает три различных домена и восемь субдоменов.
Домен I состоит из трех субдоменов: субдомен 1 − АПБ-S-ацетилтрансфераза, 60 кДа; субдомен 2 − АПБ-S-малонилтрансфераза, 23 кДа; субдомен 3 − β-кетоацил-АПБ-синтаза (конденсирующий фермент, 45 кДа). Домен I катализирует присоединение субстратов ацетил-СоА и малонил-СоА ацетилтрансферазой и малонилтрансферазой соответственно и последующую конденсацию обоих партнеров β-кетоацил-синтазой.
Домен II также состоит из трех субдоменов: субдомен 4 − β-кетоацил-АПБ-редуктаза, 21 кДа; субдомен 5 − β-гидроксиацил-АПБ-дегидратаза, 50 кДа; субдомен 6 − еноил-АПБ-редуктаза, 14 кДа. К субдомену 4 присоединен ацилпереносящий белок (АПБ), 15 кДа. Домен II восстанавливает растущую цепь ЖК с помощью вышеназванных трех ферментов.
Домен III содержит субдомен 7 − ацил-АПБ-гидролаза, тиоэстераза, 33 кДа. Домен III после семь циклов удлинения цепи катализирует высвобождение готового продукта − пальмитата с помощью гидролитического фермента тиоэстеразы.
В настоящее время показано, что многие ферменты организованы в мультиферментные ансамбли. По мере роста наших знаний в деталях, число их увеличивается. Сплайсинг мРНК осуществляется в сплайсосомах, транскрипция осуществляется в транскрипционных комплексах. В синтез белка вовлечено множество ферментов, мРНК и рибосомы, образующие трансляционный комплекс. Деградация белков осуществляется протеосомами.
Кроме того, существуют доказательства мультиэнзимных систем в других путях (обозначенных метаболонами, от слова метаболизм ‒ обмен веществ), таких как гликолиз, цикл лимонной кислоты, синтез нуклеотидов, синтез мочевины, ЦТК, окисление жирных кислот и аминокислотный метаболизм.
Метаболоны
Одним из элементов пространственной организации ферментов является метаболон – надмолекулярный комплекс, объединяющий ферменты определенного метаболического пути. Предположение о существовании такого комплекса – гликолитического метаболона было высказано еще в 1956 г. Грином с соавт., изучавшими активность гликолитических ферментов мембранных фракций эритроцитов быка.
Метаболоны формируются на подложках, в роли которых могут выступать биологические мембраны, структурные белки мышц и некоторые клеточные структуры. Подложка содержит белок, который выполняет якорные функции.
Фиксация на подложке обеспечивает однозначность сборки комплекса, а также создает центр управления, чувствительный к новым регуляторным факторам, в первую очередь к вторичным мессенджерам.
Рассмотрим образование комплекса гликолитических ферментов в эритроцитах. По мнению Б.И. Курганова с соав. роль якорной площадки, обеспечивающей фиксацию метаболона на мембране эритроцитов, играет белок полосы 3 – интегральный мембраносвязанный гликопротеин с молекулярной массой 93 кДа, основной функцией которого является транспорт анионов через мембрану эритроцитов. Существует в димерной форме, но при образовании метаболона образует замкнутую структуру, а именно тримера димеров, т.е. гексамер (рис. 4.1.6).
Рис. 4.1.6. Гликолитический метаболон (комплекс ферментов гликолиза в эритроцитах)
В сборке метаболона на белке полосы 3 ключевую роль играет фермент фосфофруктокиназа (ФФК), самого большого по размерам гликолитического фермента. Стехиометрия связывания фермента такова: одна тетрамерная молекула ФФК связывается димером БП3. Таким образом, гексамер БП3 должен связывать 3 молекулы ФФК. Далее к ФФК присоединяется альдодаза и глицеральдегид-3-фосфатдегидрогеназа (Г3ФД). Молекула эритроцитарной ФФК является тетрамером, но в отличие от мышечного фермента, построенного из идентичных субъединиц с молекулярной массой 85 кДа, фермент из эритроцитов содержит одну субъединицу мышечного типа (М) и три субъединицы (Е) с молекулярной массой 80 кДа и с аминокислотным составом, отличающимся от такового для субъединицы мышечного типа (тетрамер МЕ 3). Принцип построения метаболона таков: ферменты, связанные общими метаболитами или коферментами, находятся в метаболоне рядом друг с другом. Такое расположение ферментов метаболического пути, во-первых, может обеспечить эффективное продвижение метаболических интермедиатов по конвейеру активных центров в микрокомпартменте, образующемся при сборке метаболона. Во-вторых, благодаря сближению дегидрогеназ, NADH, образующийся в ходе реакции, катализируемой Г3ФД, может прямо реокисляться до NAD + с участием глицерол-3-фосфатдегидрогеназы и лактатдегидрогеназы (ЛДГ) без выхода кофермента из компартмента. Аналогично, благодаря сближению фосфотрансфераз, часть АТР, продуцируемого фосфоглицераткиназой и пируваткиназой, может использоваться ФФК.
Принцип построения метаболона таков: ферменты, связанные общими метаболитами или коферментами, находятся в метаболоне рядом друг с другом. Такое расположение ферментов метаболического пути, во-первых, может обеспечить эффективное продвижение метаболических интермедиатов по конвейеру активных центров в микрокомпартменте, образующемся при сборке метаболона. Во-вторых, благодаря сближению дегидрогеназ, NADH, образующийся в ходе реакции, катализируемой Г3ФД, может прямо реокисляться до NAD + с участием глицерол-3-фосфатдегидрогеназы и лактатдегидрогеназы (ЛДГ) без выхода кофермента из компартмента. Аналогично, благодаря сближению фосфотрансфераз, часть АТР, продуцируемого фосфоглицераткиназой и пируваткиназой, может использоваться ФФК.
Гликолитический метаболон содержит тройной набор ферментов. Молекулярная масса его составляет 4х106 Да. В метаболон, изображенный на рис.4.1.6. не включен фермент гексокиназа, но она контактирует с метаболической системой. Это физиологически выгодно, поскольку в этом случае возможно прямое использование АТР, продуцируемое гликолитическим комплексом.
Сборка комплекса гликолитических ферментов приводит к образованию микрокомпартмента, в котором гликолитический процесс может протекать без выхода гликолитических интермедиатов в объем. Микрокомпартмент состоит из трех отсеков, каждый из которых содержит активные центры всех гликолитических ферментов и обеспечивает, таким образом, полную химическую трансформацию поступающего в компармент глюкозо-6-фосфата.
Метаболон – это мобильная структура, он находится в равновесии со свободными ферментами. Согласно данным Дженкинса с соавт. в интактных эритроцитах человека около 50% ФФК и 40% альдолазы связаны с мембраной. Количество полноценных комплексов, формирование которых начинается с посадки ФФК на якорную площадку мембраны эритроцитов, зависит прежде всего от соотношения между концентрацией ФФК и других белков, способных конкурировать с ФФК за связывание на белке полосы 3. К числу таких белков относится не только альдолаза и Г3ФД, но и гемоглобин. Дезоксиформа гемоглобина обладает более высоким сродством к БП3, чем оксигемоглобин, и поэтому можно ожидать, что при снижении количества кислорода в эритроцитах количество адсорбированных гликолитических ферментов будет уменьшаться.
ЛЕКЦИЯ 4.2
 2017-12-16
2017-12-16 1212
1212








