а) Елемент Вольта Цей елемент складається з двох пластинок: цинкової (–) і мідної (+), опущених у 10-процентний розчин сірчаної кислоти (рис. 1.17). Елемент цей швидко поляризується. Його мідний електрод вкривається бульбашками водню, що призводить до його ізоляції від розчину, внаслідок чого внутрішній опір елемента збільшується і струм швидко слабшає. В послабленні струму також значну роль відіграє е.р.с. поляризації. Тому елементом Вольта як джерелом струму в лабораторіях не користуються.
b) Елемент Лекланше (рис.1.18) складається з двох електродів: цинкового (–) і вугільного (+), опущених у 20-процентний розчин нашатирю (NH4Cl).
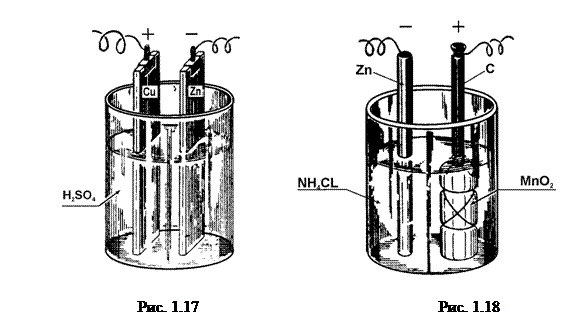
Деполяризатором є перекис марганцю (MnO2), що оточує вугільну пластинку. Е.р.с. цього елемента» 1,5В. У так званих “сухих” елементах Лекланше згаданим вище електролітом насичується тирса або інша речовина, якою заповнюють весь простір між електродами. Через те, що деполяризатор у цьому елементі твердий, то деполяризація відбувається повільно. Тому при тривалій роботі е.р.с. елемента зменшується. При короткочасному замиканні елемент працює добре.
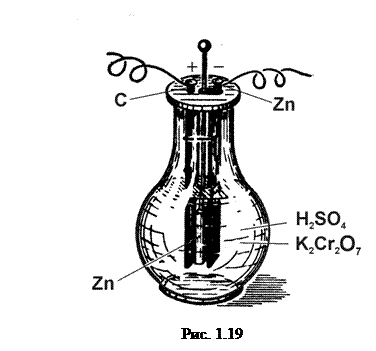
c) Елемент Грене зображено на рис. 1.19. Він складається з цинкового (–) і вугільного (+)електродів, опущених у розчин сірчаної кислоти.
Для знищення поляризації в цей електроліт додають розчину двохромового калію (K2Cr2O7). (На 100 вагових частин води – 16 частин двохромового калію та 37 частин сірчаної кислоти). Е.р.с. елемента Грене»2 В. Щоб уникнути зайвого розчинення цинкового електроду, його занурюють у розчин лише під час роботи елемента.
 |
Г) Елемент Даніеля
У скляну посудину (рис. 1.20), наповнену насиченим розчином мідного купоросу (CuSO4), опущено мідний електрод (+), а також пористий циліндр з легко обпаленої глини, наповнений слабким розчином сірчаної кислоти (1 об’єм кислоти на 20 об’ємів води), в який і вставляється цинковий електрод (–).
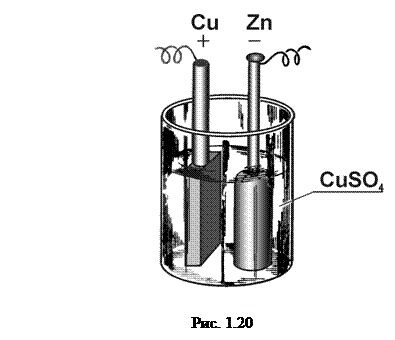 |
Деполяризатором в цьому елементі є мідний купорос. Водень, що виділяється під час роботи, дифундує через стінки пористої посудини і, з’єднуючись з CuSO4, витісняє мідь, утворюючи сірчану кислоту. Вільна ж мідь осідає на мідній пластинці. Елемент Даніеля має досить стійку е.р.с. (» 1,09В).
 d) Нормальний елемент Вестона Величина е.р.с. згаданих вище елементів у значній мірі залежить не тільки від чистоти матеріалів, з яких виготовлено елемент, а ще й від зовнішніх умов роботи елемента. Через те елементи Лекланше, Грене і Даніеля не можуть бути еталонами е.р.с.
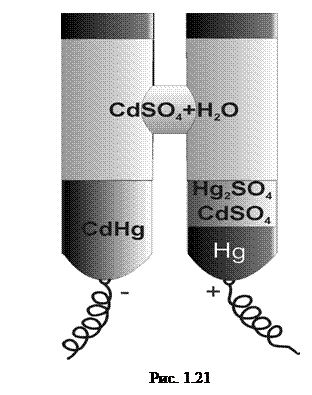
d) Нормальний елемент Вестона Величина е.р.с. згаданих вище елементів у значній мірі залежить не тільки від чистоти матеріалів, з яких виготовлено елемент, а ще й від зовнішніх умов роботи елемента. Через те елементи Лекланше, Грене і Даніеля не можуть бути еталонами е.р.с.
Елемент Вестона, який виготовляють з хімічно чистих матеріалів, при температурі 20°С має е.р.с. 1,0183В. (Температура дуже мало впливає на величину е.р.с.). Додатним полюсом елемента Вестона (рис. 1.21) є ртуть, що міститься на дні однієї із сполучених між собою пробірок, а відємним – амальгама кадмію, що міститься на дні іншої пробірки.
1. 4.2. Акумулятори.
У гальванічних елементах внаслідок хімічних реакцій між цинком і електролітом (а в елементі Вестона між кадмієм і електролітом) виникає електричний струм. Дія ж і виготовлення акумуляторів ґрунтується на поляризації (фізико-хемічних змінах складу) електродів при проходженні постійного струму через електролітичну ванну. Акумулятори спочатку заряджають, пропускаючи через них постійний струм, а потім вже від них беруть струм, як від гальванічних елементів. Через те гальванічні елементи називаються елементами першого роду, або первинними, а акумулятори називаються елементами другого роду, або вторинними.
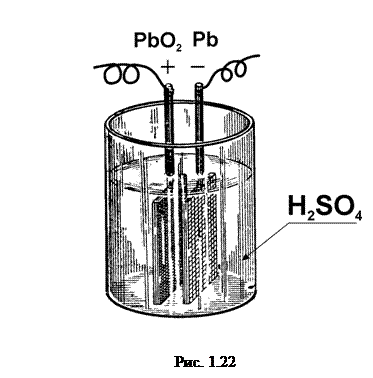
а) Кислотний (свинцевий) акумулятор Принцип будови кислотного акумулятора наведено на рис. 1.22. Він складається з двох свинцевих гратчастих пластин, в отвори яких впресовано активну масу. Ці пластинки занурені у 20-25-процентний розчин сірчаної кислоти. Густина розчину приблизно 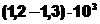 кг/м3.
кг/м3.
При пропусканні постійного струму пластини хімічно змінюються: анод покривається пористим шаром перекису свинцю (PbO2), а катод стає чистим свинцем (Pb).
Заряджений акумулятор є вже джерелом електричної енергії.
При розрядженні цього акумулятора хімічна реакція йде у зворотному напрямі, причому свинець (Pb) і перекис свинцю (PbO2) переходять у сірчанокислу сіль свинцю (PbSO4).
Е.р.с. кислотного акумулятора можна вважати рівною 2В. При повному зарядженні вона доходить до 2,7В, але при розрядженні швидко спадає до 2В. Нижче 1,85В розряджати акумулятор не слід, бо це призводить до зменшення його коефіцієнта корисної дії. При роботі з кислотними акумуляторами не можна допускати коротких замикань, які приводять їх до непридатності в результаті руйнування пластин.
b) Лужні залізно-нікельові акумулятори В цих акумуляторах
(рис. 1.23) на позитивному полюсі міститься суміш окису нікелю з графітним порошком, а на негативному – окис заліза з домішкою ртуті.
Електролітом є 20-процентний розчин їдкого калію (KOH). Е.р.с. лужного акумулятора дорівнює 1,25В (при повній зарядці досягає 1,8В).
Лужні акумулятори, порівняно з кислотними, легші, міцніші і витриваліші. Вони не так бояться коротких замикань, як кислотні, і не виділяють їдких газів. Однак, слід пам’ятати, що лужні акумулятори розряджати нижче 1,18В не слід, з тих причин, що й кислотний акумулятор.
 |
Якщо треба мати напругу більшу, ніж дає один елемент або акумулятор, то сполучають послідовно відповідну кількість елементів або акумуляторів у батарею.
Зберігати в одному місці лужні та кислотні акумулятори не дозволяється. Слід обережно поводитись з кислотою (H2SO4) та лугом (KOH), які викликають опіки, псують одяг. Ушкоджені лугом чи кислотою місця необхідно добре промити водою.
 2018-01-08
2018-01-08 1947
1947
