Метод нанесения электрохимических (гальванических) покрытий получил широкое распространение в промышленности.
Основные преимущества:
- возможность получения покрытий строго определенного состава, свойств и толщины;
- повышенные механические и антикоррозионные свойства покрытий;
- отсутствие промежуточного хрупкого состава;
- возможность механизации и автоматизации процесса;
- небольшие потери материала;
- высокая экономическая целесообразность.
Основные недостатки:
- необходимость внешнего источника тока;
- значительный разброс значений толщины покрытий на наружной и внутренней поверхностях профилированных деталей;
- необходимость применения дополнительного оборудования и химикатов для регенерации и нейтрализации отработанных электролитов;
- более низкие санитарно-гигиенические условия труда по сравнению с другими способами.
Данный метод нанесения покрытий основан на явлении электролиза.
Сущность электролиза состоит в разложении электролитов (т.е. водных растворов или расплавов солей, кислот или оснований) в которых растворенные молекулы распадаются на положительно и отрицательно заряженные ионы постоянным электрическим током, которое сопровождается образованием новых веществ. Химическая сущность электролиза заключается в окислительно-восстановительных реакциях на электродах.
Рассмотрим электролиз водного раствора хлорида меди (II). В растворенном состоянии хлорид меди состоит из беспорядочно перемещающихся положительно заряженных ионов меди Cu2+ и отрицательно заряженных хлорид-ионов Cl-:
CuCl2↔Cu2++2Cl-
Если в раствор погрузить два электрода и соединить их с источником постоянного тока, то один из электродов заряжается положительно (анод), другой – отрицательно (катод). Ионы в растворе приобретают направленное движение. Под действием электрического поля катионы Cu2+ движутся к отрицательному электроду – катоду, а анионы Cl- - к положительному электроду – аноду. На катоде катионы присоединяют электроны и превращаются в электронейтральные атомы:
Cu2++2ē=Cu0
Атомы меди образуют кристаллическую решетку – на катоде осаждается металлическая медь.
На аноде анионы хлора наоборот отдают электроны и окисляются в атомы хлора:
2Cl- - 2ē=Cl2
Атомы хлора объединяются далее в молекулы:
Cl+Cl=Cl2
и на аноде выделяется свободный хлор.
Суммарное уравнение реакции следующее:
CuCl2→Cu+Cl2
Для количественной оценки электролиза служат следующие характеристики:
- выход по току;
- расход энергии;
- расходный коэффициент по энергии.
Выходом по току η называется отношение количества практически полученного при электролизе вещества gп к теоретическому gт.
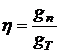 (9.1)
(9.1)
Теоретическое количество выделившегося вещества определяется по закону Фарадея:
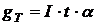 (9.2)
(9.2)
где I - сила тока, проходящего через электролит, А;
t - продолжительность электролиза, ч;
α - теоретический электрохимический эквивалент вещества, г/А·ч.
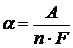 (9.3)
(9.3)
где А - атомный вес или масса иона (для меди 63, 57);
n - валентность иона (для меди 2);
F - число Фарадея, соответствующая теоретическому количеству электричества, которое нужно пропустить через электролит для выделения одного грамм эквивалента вещества:
F=95500 кулон/г - экв. (26,8 А·ч/ г - экв.)
Расход энергии Wп, затраченной на электролиз, определяется по формуле:
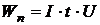 (9.4)
(9.4)
где U - напряжение на ванне, В
I - сила тока, проходящего через электролит, А;
t - продолжительность электролиза, ч;
Расходный коэффициент по энергии β, т.е. расход энергии на весовую единицу продукта электролиза, рассчитывается по формуле:
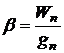 (9.5)
(9.5)
Процесс электролиза можно изучать на установке, показанной на рисунке 9.1. Установка состоит U-образной трубки (2), куда помещены два электрода (3). В U-образную трубку наливается электролит (1). Электроды подключаются к источнику постоянного тока (5), причем положительным должен быть электрод, расположенным рядом с тубусом (4) для возможности выхода газообразных продуктов.
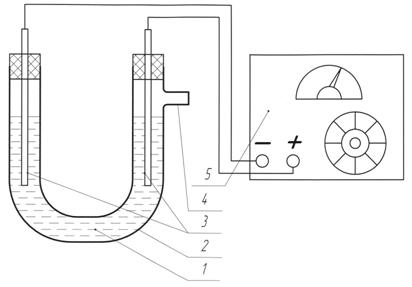
Рисунок 9.1- Схема лабораторной установки для изучения процесса электролиза
1 – электролит; 2 - U-образная трубка; 3 – электроды; 4 – тубус; 5 – источник постоянного тока
 2018-01-08
2018-01-08 240
240








