Полиморфизм металлов
Существование разных типов кристаллических решеток у одного и того же вещества при различных температуре и давлении называется полиморфизмом или аллотропией, а процесс перехода из одной кристаллической формы в другую — полиморфным или аллотропическим превращением. Ряд элементов — Со, Ti, Мп, Sn, Са, Li, Feи др. имеют два и более типа (модификации) кристаллических решеток, обозначаемых малыми буквами греческого алфавита (а, |3, у и т.д.), начиная с той формы, которая существует при наиболее низкой температуре.
Процесс перехода из одной формы в другую определяется термодинамическим состоянием системы и объясняется тем, что, начиная с определенной температуры (температуры перекристаллизации), новая модификация обладает меньшим запасом энергии, чем предыдущая, И является энергетически более устойчивой. Температура, при которой осуществляется переход из одной модификации в другую, называется температурой полиморфного превращения. Новые полиморфные формы образуются в результате зарождения центров и роста кристаллов аналогично кристаллизации из жидкого состояния.
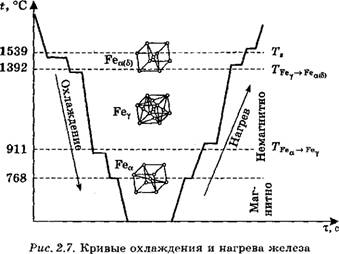
|
На рис. 2.7 приведены кривые охлаждения и нагрева железа, характеризующие его полиморфные превращения. При температурах ниже 911 °С и выше 1392 °С железо имеет объемноцен- трированную кубическую решетку и обозначается Fea. При температурах 911...1392 °С оно имеет гранецентрированную кубическую решетку и обозначается FerВысокотемпературную модификацию Feaиногда обозначают Fe6.
При температуре 768 °С (точка Кюри) происходит изменение магнитных свойств железа: ниже 768 °С оно магнитно, выше — немагнитно (немагнитное a-железо иногда называют р-железом).
Основные сведения о металлических сплавах
В машиностроении чистые металлы не находят широкого применения, так как в большинстве случаев они не обеспечивают требуемого комплекса механических и технологических свойств. Чаще используют металлические сплавы — вещес!тва, состоящие из двух и более элементов. Элементы, из которых образован сплав, называют его компонентами.
Компонентами могут быть химические элементы (металлы и неметаллы) или устойчивые химические соединения.
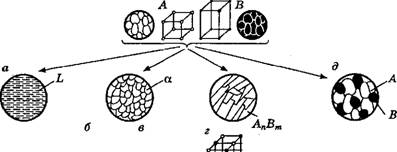
В жидком состоянии компоненты сплава в большинстве случаев полностью растворимы друг в друге и представляют собой жидкий раствор (рис. 2.8,а), в котором атомы различных элементов равномерно перемешаны друг с другом. При кристаллизации компоненты сплава вступают во взаимодействие, от характера которого зависит его строение. Наиболее часто встречаются твердые растворы, химические соединения и механические смеси.
Твердым раствором называется вещество, состоящее из двух или более компонентов, один из которых, сохраняя кристаллическую решетку, является растворителем, а другой (или другие) распределяется в кристаллической решетке растворителя, не изменяя ее типа.
Микроструктура твердого раствора в условиях равновесия представляет совершенно однородные и одинаковые по составу зерна и похожа на структуру чистого металла. В зависимости от характера распределения атомов растворенного вещества в кри
сталлической решетке растворителя различают твердые растворы замещения (рис. 2.8, б) и внедрения (рис. 2.8,в). Растворимость в твердом состоянии ^южет быть неограниченной и ограниченной. При неограниченной растворимости возможна любая концентрация (от 0 до 100 %) растворенного вещества (при концентрации более 50 % растворенное вещество становится растворителем).
Для образования твердых растворов замещения с неограниченной растворимостью необходимо соблюдение следующих условий:
□ изоморфность (однотипность) кристаллических решеток сплавляемых компонентов;
□ близость атомных радиусов компонентов, которые не должны отличаться больше чем на 8...13 %;
□ близость физико-химических свойств компонентов.
Если два компонента сплава не отвечают перечисленным выше
условиям, то они могут растворяться друг в друге лишь ограниченно. В реальных сплавах чаще наблюдаются твердые растворы с ограниченной растворимостью.
Химическим соединением (рис. 2.8, г) называют вещество, характерными особенностями которого являются:
| тГ |
| Рис. 2.8. Фазы в металлических сплавах: а — жидкий растворL; б — твердый раствор а-замещения; в — твердый раствор а-внедрения; г — химическое соединение АпВт; д — механическая смесь А и В |
| 47147! UvW |
| ш |
□ постоянство состава, выраженное формулой, которая отвечает определенному соотношению количеств атомов компонентов А и В в нем;
□ наличие нового типа кристаллической решетки, отличающегося от типов решеток сплавляемых компонентов;
□ ярко выраженное существенное изменение всех свойств.
В отличие от твердых растворов химические соединения обычно образуются между компонентами, имеющими различия в электронном строении атомов.
Механическая смесь (рис. 2.8, д) образуется, когда компоненты сплава не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием химического соединения. При этом образуется двухфазная структура сплава, представленная чередующимися зернами чистых компонентов А к В.
При изучении явлений, протекающих в металлах и сплавах в процессе их превращений, пользуются понятиями «система», «фаза», «компонент».
Системой называется совокупность фаз, находящихся в равновесии при определенных внешних условиях (температура, давление). Система может быть простой, если она состоит из одного элемента (чистый металл), и сложной — из нескольких элементов (сплав).
| 2.6. |
Фазой называется однородная по химическому составу и внутреннему строению часть системы, отделенная от других частей поверхностью раздела. Фазами могут быть металлы и неметаллы, жидкие и твердые растворы, химические соединения. Однофазной системой является, например, однородная жидкость, двухфазной — механическая смесь кристаллов двух металлов.
Диаграммы состояния двойных сплавов
Процесс кристаллизации металлических сплавов и связанные с ним закономерности их строения отражаются на диаграммах состояния. Эти диаграммы представляют собой графическое изображение фазового состояния сплавов в зависимости от температуры и концентрации компонентов в условиях равновесия и строятся в координатах температура — состав сплава (рис. 2.9, а).
Общие закономерности сосуществования устойчивых фаз, отвечающих теоретическим условиям равновесия, могут быть
выражены в математической форме, называемой правилом фаз или законом Гиббса:
C = k-f + 2,
где С — число степеней свободы системы;k— число компонентов в системе;f— число фаз в системе.
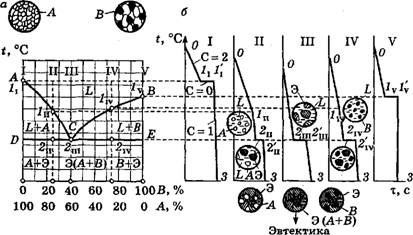 Рис. 2.9. Диаграмма состояния I рода (а), кривые охлаждения сплавов I...Vи схемы ИХ структур (б): АСВ — ликвидус;DCE— солидус
Рис. 2.9. Диаграмма состояния I рода (а), кривые охлаждения сплавов I...Vи схемы ИХ структур (б): АСВ — ликвидус;DCE— солидус
|
Под числом степеней свободы системы понимают число внешних и внутренних факторов (температура, давление, концентрация), которые можно изменять без изменения числа фаз в системе. Если число степеней свободы равно единице, то можно изменить в некоторых пределах один из перечисленных факторов и это не вызовет уменьшение или увеличение числа фаз.
Если принять, что все превращения в металле происходят при постоянном давлении, то число переменных уменьшится на единицу (давление постоянно), и уравнение правила фаз примет следующий вид:
C = k-f +1.
Для случая кристаллизации чистого металла, когда металл находится в жидком состоянии, / = 1 (одна фаза — жидкость), а число степеней свободы равно 1(1-1 1 = 1). В момент кристаллизацииf — 2 (две фазы — твердая и жидкая), а С = k — f + 1 = = 1 — 2 + 1=0. Это означает, что две фазы находятся в равновесии при строго определенной температуре (температуре плавления), и она не может быть изменена до тех пор, пока одна из фаз не исчезнет.
Подобным образом можно рассчитать число степеней свободы и для случая кристаллизации сплавов.
Для построения диаграммы используют кривые охлаждения чистых компонентов, образующих систему (в общем случае А и В), и их сплавов различного состава, полученные методом термического анализа (рис. 2.9, б). По кривым охлаждения определяют температуры фазовых превращений — критические точки. На кривых охлаждения I и V чистых компонентов А и В имеется только по одной критической точке, так как кристаллизация чистых металлов протекает при постоянной температуре (см. 2.3).
Процесс кристаллизации сплавов II...IV протекает иначе: сначала в интервале температур между точками 1 и 2, а затем при постоянной температуре (точки 2 и 2'). Ниже этой температуры происходит охлаждение уже твердого вещества. Первая критическая точка (1), отвечающая началу кристаллизации, называется ликвидус, а вторая(2), отвечающая концу кристаллизации, — солидус.
Если полученные температуры нанести на вертикальные линии для чистых компонентов А и В и выбранных составов сплавов и соединить одной линией точки, отвечающие началу кристаллизации — ликвидус, а другой — точки, отвечающие концу кристаллизации — солидус, то получим диаграмму состояния, показанную на рис. 2.9, а. На этой диаграмме линия АСВ (ликвидус) — линия начала затвердевания сплавов. Выше температур этой линии все сплавы данной системы находятся в жидком состоянии. ЛинияDCE(солидус) — линия конца затвердевания сплавов. При температурах ниже этой линии все сплавы системы находятся в твердом состоянии. Между этими линиями часть сплава находится в твердом состоянии, а часть — в жидком.
Диаграммы состояния позволяют определить состав фаз и их количественное соотношение в условиях равновесия при определенной температуре; проследить превращения, протекающие при охлаждении и нагревании; определить температуру начала и конца плавления (затвердевания) сплава; выяснить, будет ли сплав однородным, каковы его жидкотекучесть, пористость, а также выбрать необходимые виды термической обработки сплава.
В процессе кристаллизации любого сплава состав и количество каждой фазы изменяются: количество жидкой фазы уменьшается, а твердой — увеличивается. Количество фаз и их состав в любой точке диаграммы можно определить с помощью следующего правила отрезков. Для определения концентрации компонентов в фазах через заданную точку, характеризующую состояние сплава, проводят горизонтальную линию до пересечения с линиями, ограничивающими данную область диаграммы. Точки пересечения указывают на фазы, находящиеся в равновесии, а проекции точек пересечения на ось концентраций показывают составы этих фаз. Массовые (объемные) доли твердой и жидкой фаз в сплаве обратно пропорциональны отрезкам линии между заданной точкой и точками, определяющими составы этих фаз.
В зависимости от характера образующихся в сплавах структурных составляющих (механическая смесь, твердый раствор, химическое соединение) различают следующие типы диаграмм состояния:
□ с полной нерастворимостью компонентов в твердом состоянии;
□ с полной растворимостью компонентов в твердом состоянии;
□ с ограниченной растворимостью компонентов;
а компоненты образуют химическое соединение.
2.6.1. Диаграмма состояния для сплавов, компоненты которых нерастворимы в твердом состоянии (I рода)
Компоненты сплава А и В данной системы неограниченно растворимы в жидком состоянии (L) и нерастворимы в твердом, образуя механические смеси из чистых компонентов (пример такой диаграммы приведен на рис. 2.9, а). При охлаждении сплавов на ветви ликвидуса АС начинают выделяться кристаллы вещества А, а на ветви СВ — кристаллы В. На линииDCEиз жидкости состава, соответствующего проекции точки С на ось концентрации, одновременно выделяются кристаллы А и В в виде механической смеси.
На рис. 2.9, б приведены кривые охлаждения трех сплавов. Для сплавов II, IV на участке 0-1 идет охлаждение жидкого сплава, на участке 1-2 в сплаве II из жидкости выделяются кристаллы компонента А, а в сплаве IV — кристаллы компонента В. На участке 2-2' у обоих сплавов совместно выделяются кристаллы А и Б, а на участке 2'-3 происходит охлаждение твердого вещества.
В сплаве III на участке 0-2 происходит охлаждение жидкого сплава, на участке 2-2' совместно выделяются кристаллы А и В, на участке 2'-3 происходит охлаждение твердой фазы.
Схемы структур сплавов в разные моменты кристаллизации показаны на том же рисунке. В сплаве II из жидкости выделяются кристаллы А, затем оставшаяся жидкость кристаллизуется с одновременным выделением кристаллов А и Б. В левом нижнем кружке показана структура уже закристаллизовавшегося сплава, состоящего из первичных кристаллов А и механической смеси кристаллов А и В, которые кристаллизовались одновременно. В сплаве IV (правый нижний кружок) структура состоит из первичных кристаллов Б и механической смеси кристаллов А и В.
Механическая смесь двух (или более) видов кристаллов, одновременно кристаллизовавшихся из жидкости, называется эвтектикой. Температура, при которой образуется эвтектика, называетсяэвтектической температурой, а состав сплава, при котором образуется эвтектика, называется эвтектическим (сплав концентрации точки С). Линия ВСЕ — линия образования эвтектики. Все сплавы данной системы окончательно затвердевают при эвтектической температуре. Сплавы, лежащие левее точки С, называются доэвтектическими, а правее — заэвтектическими.
Диаграммы такого типа имеют системы Pb-Sb, Sn-Zn.
2.6.2. Диаграмма состояния для сплавов, компоненты
которых неограниченно растворимы в твердом
состоянии (II рола)
Оба компонента сплава (А и В) неограниченно растворимы в жидком (L) и твердом состоянии и не образуют химических соединений. Диаграмма имеет простой вид и показана на рис. 2.10, а, где линия АтВ — ликвидус, АпВ — солидус.
Структура всех этих сплавов однофазная и состоит из зерен, которые представляют собой твердый раствор одного компонента в другом (рис. 2.10, б). Из кривых охлаждения сплавов видно,
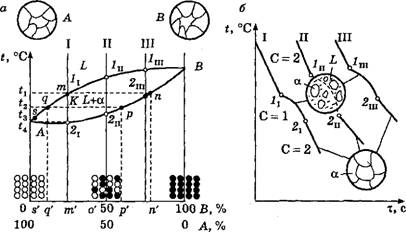 Рис. 2.10. Диаграмма состояния II рода (а), кривые охлаждения сплавов I, II, III и схемы их структур (б)
Рис. 2.10. Диаграмма состояния II рода (а), кривые охлаждения сплавов I, II, III и схемы их структур (б)
|
что до точки 1 происходит охлаждение жидкого сплава, на участке 1-2 — кристаллизация твердого раствора, а ниже точки 2 — охлаждение уже твердого вещества.
Рассмотрим процесс затвердевания одного из сплавов этой системы. Кристаллизация сплава I начинается при температуре t^ Из жидкой фазы состава т выделяются кристаллы твердого раствора состава п, обогащенные компонентом В.
При дальнейшем охлаждении до температурыt2в равновесии с жидкостью составаqнаходятся кристаллы твердого а-раствора состава р. При кристаллизации сплава I состав жидкости непрерывно меняется по линииms,а твердого раствора — по линии л2,. В результате медленного охлаждения в равновесных условиях успевает произойти диффузионное перераспределение компонентов между жидкой и твердой фазами. Поэтому к моменту окончания процесса кристаллизации при температуреt3все зерна твердого раствора будут иметь одинаковый состав.
Определим состав и количество фаз в точке К. В соответствии с правилом отрезков в точке К в равновесии находятся жидкая фаза (точкаq)и твердая фаза (точка р). Количественная масса фаз обратно пропорциональна отрезкам проведенной коноды. Количество жидкой фазы определяется соотношением Кр:qp,а коли
чество твердой фазы — соотношениемqK:qp.Состав жидкой фазы определяется проекцией точки пересечения горизонтали с линией ликвидусаqна ось концентрации (точкаq').Состав твердой фазы определяется проекцией точки пересечения горизонтали с линией солидуса р на ось концентрации (точка р').
В реальных условиях охлаждения состав кристаллов получается неоднородным. Это происходит потому, что скорость кристаллизации больше скорости диффузии и у кристаллов, образующихся при температуре вышеt4,не успевает произойти диффузионное перераспределение компонентов. Внутренние участки кристалла обогащаются тугоплавким компонентом В, а наружные — компонентом А. Такая неоднородность химического состава называется внутрикристаллической или дендритной ликвацией. Ликвация чаще всего играет отрицательную роль, так как ухудшает технологические и механические свойства сплавов.
Диаграммы такого типа имеют системы Ni-Cu, Ag-Au, Mo-V, Mo-Wи др.
Диаграмма состояния для сплавов, компоненты
 2018-01-08
2018-01-08 996
996







