Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
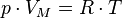 ,
,
где
· 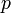 — давление,
— давление,
· 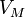 — молярный объём,
— молярный объём,
· 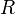 — универсальная газовая постоянная
— универсальная газовая постоянная
· 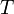 — абсолютная температура,К.
— абсолютная температура,К.
Так как 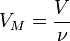 , где
, где 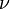 — количество вещества, а
— количество вещества, а 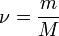 , где
, где 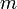 — масса,
— масса, 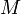 — молярная масса, уравнение состояния можно записать:
— молярная масса, уравнение состояния можно записать:
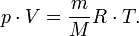
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
Уравнение, выведенное Клапейроном содержало некую неуниверсальную газовую постоянную  , значение которой необходимо было измерять для каждого газа:
, значение которой необходимо было измерять для каждого газа:
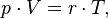
Менделеев же обнаружил, что  прямо пропорциональна
прямо пропорциональна 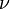 , коэффициент пропорциональности
, коэффициент пропорциональности 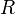 он назвал универсальной газовой постоянной.
он назвал универсальной газовой постоянной.
[править]Связь с другими законами состояния идеального газа
В случае постоянной массы газа уравнение можно записать в виде:
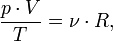
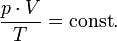
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
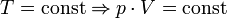 — закон Бойля — Мариотта.
— закон Бойля — Мариотта.
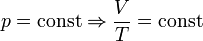 — Закон Гей-Люссака.
— Закон Гей-Люссака.
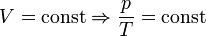 — закон Шарля (второй закон Гей-Люссака, 1808 г.)
— закон Шарля (второй закон Гей-Люссака, 1808 г.)
А в форме пропорции 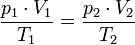 этот закон удобен для расчёта перевода газа из одного состояния в другое.
этот закон удобен для расчёта перевода газа из одного состояния в другое.
Изопроцессы в идеальном газе
 2018-01-08
2018-01-08 649
649








