ОПРЕДЕЛЕНИЕ СРЕДНЕЙ ИЗОБАРНОЙ ТЕПЛОЁМКОСТИ ВОЗДУХА
1. Цель работы:
а) приобретение навыков экспериментального определения средней объёмной изобарной теплоёмкости воздуха с помощью проточного калориметра;
б) вычисление по измерянным величинам средних объёмной, массовой и мольной изобарной теплоёмкости воздуха;
в) оценка точности экспериментального определения средней изобарной теплоёмкости воздуха.
2. Пояснение к работе
Отношение элементарного количества теплоты dq, подводимого к единице количества вещества в данном термодинамическом процессе, к изменению температуры DТ вещества в этом процессе называется средней теплоёмкостью, то есть
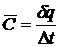 (1)
(1)
Предел этого отношения
 (2)
(2)
является истинной теплоёмкостью в данной точке термодинамического процесса. Это есть математические определения средней и истинной теплоёмкостей.
С физической точки зрения средняя теплоёмкость есть количество теплоты, необходимое для нагрева единицы количества вещества на один градус в данном интервале температур в заданном процессе.
Из совместного рассмотрения этих определений теплоёмкости следует, что, во-первых, теплоёмкость в общем случае есть функция процесса. Однако она становится функцией состояния, когда термодинамический процесс задан. Во-вторых, средняя теплоёмкость в заданном процессе может быть определена экспериментально, а истинная – только рассчитана из соотношения (2).
Количество рабочего тела (вещества) может быть задано в килограммах, киломолях и нормальных кубических метрах. В связи с этим, соответственно различают массовую, мольную и объёмную теплоёмкости, имеющие размерности кДж/(кг×К), кДж/(кмоль×К) и кДж/(нм3×К).
Теплоёмкость реального газа в заданном термодинамическом процессе зависит от двух параметров состояния, и чаще всего её представляют в табличной либо аналитической форме в зависимости от температуры и давления или от температуры и удельного объёма. Для идеального газа теплоёмкость зависит только от температуры: С = f (Т). Наконец, в рамках упрощенной молекулярно-кинетической теории зависимость теплоёмкости от температуры не учитывается, а учитывается только её зависимость от строения молекулы вещества: от числа атомов в молекуле рассматриваемого газа. По этой концепции изобарная и изохорная теплоёмкости рассчитываются из соотношений:
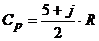 и
и 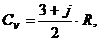 (3)
(3)
где: j – число вращательных внутримолекулярных степеней свободы:
для одноатомных молекул j = 0;
для двухатомных молекул j = 2;
для трёх и более атомных молекул j = 3;
R - газовая постоянная, к Дж/(кг×К).
Количество теплоты, подводимое к телу в заданном термодинамическом процессе (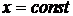 ) при изменении его температуры от t1 до t2, рассчитывается из соотношения
) при изменении его температуры от t1 до t2, рассчитывается из соотношения
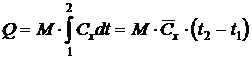
 (4)
(4)
где Сx – истинная удельная теплоёмкость вещества в заданном процессе при данной температуре;
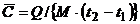 - средняя удельная теплоёмкость в заданном процессе в интервале температур [ t1 , t2 ].
- средняя удельная теплоёмкость в заданном процессе в интервале температур [ t1 , t2 ].
3. Описание лабораторной установки.
В данной работе определяется изобарная теплоёмкость воздуха, так как в проточном калорифере давление воздуха при его нагреве не меняется.
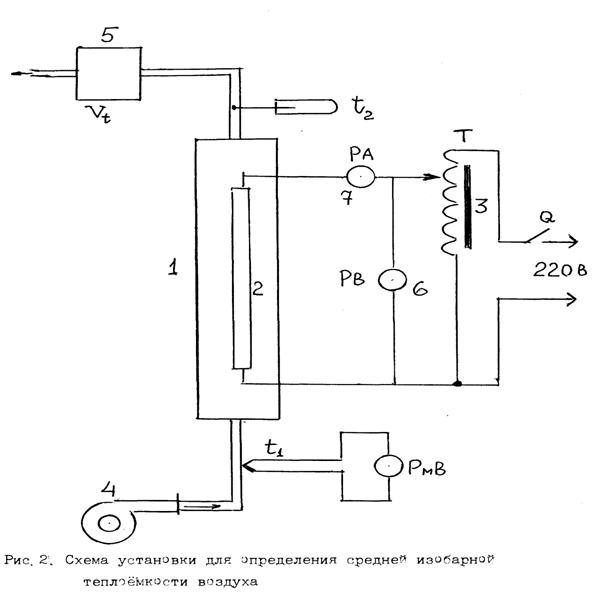
Принципиальная схема лабораторной установки приведена на рис 2.
Установка для измерения средней теплоёмкости воздуха включает: проточный калорифер - 1, электронагреватель – 2, лабораторный автотрансформатор – 3, электровентилятор – 4, газовый расходомер (счетчик) – 5, вольтметр – 6, амперметр – 7. Кроме того для проведения опытов необходимо иметь барометр для измерения атмосферного давления и секундомер (либо часы с секундной стрелкой) для измерения времени экспозиции.
4. Методика проведения опытов:
4.1. До начала выполнения измерений ознакомьтесь с устройством установки на месте.
4.2. Вначале переведите установку из стационарного холодного состояния в первое нагретое состояние. Для этого, руководствуясь схемой установки, включите установку и, не включая нагреватель, дождитесь постоянства температуры воздуха на выходе из калорифера (t2). Согласуйте показания гальванометра с этой температурой c помощью корректора, имеющегося у гальванометра (t1=t2).
4.3. Подайте при помощи автотрансформатора напряжение на нагреватель в пределах 90 –120 В. Дождитесь нового постоянства температуры воздуха на выходе из калорифера (t2), то есть второго стационарного нагретого состояния установки.
4.4. Измерения можно начинать только тогда, когда температура воздуха на выходе из проточного калориметра (t2) будет изменяться (увеличиваться) не более чем на 0,5 0С в минуту. Это, как правило, наступает при достижении температуры воздуха на выходе из калориметра (t2) примерно 40 0С.
4.5. Для проведения опыта необходимо одновременно измерить значения температур воздуха на входе (t1) и на выходе из калорифера (t2), а также показания газового счетчика (две цифры до запятой и две после). После экспозиции примерно 180 сек. повторить измерения этих параметров.
Результаты измерений записать в таблицу наблюдений (количество опытов согласовать с преподавателем).
Таблица 1
Таблица величин, измеренных в процессе проведения опытов
| №№ опытов | Показания электроприборов | Данные для расчета расхода воздуха | Температура воздуха, 0С | Атмосферное давление | ||||
| напряжение U, B | сила тока I, A | показания газового счетчика | время между замерами t, с | при входе в | при выходе из | Р атм = = мм рт. ст. = Па | ||
V  , м3 , м3 | V 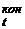 , м3 , м3 | калориметр | Примечание | |||||
| t1 | t2 | |||||||
5. Обработка результатов измерений
5.1 Рассчитываем значение средней объёмной изобарной теплоёмкости воздуха
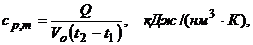 (5)
(5)
где Q = U×I × x ×10-3, кВт, то есть (кДж/с) – тепловая нагрузка калорифера в единицу времени;
x = 0,87 – доля теплоты, идущей на нагрев воздуха;
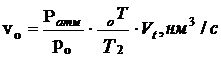 - расход воздуха через калорифер, пересчитанный к нормальным условиям.
- расход воздуха через калорифер, пересчитанный к нормальным условиям.
Обычно po = 760 мм рт. ст. или 1,01325×105 Па;
tо = 0 оС или То = 273,15 К.
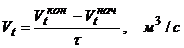 - расход воздуха, уходящего из калорифера при температуре (t2).
- расход воздуха, уходящего из калорифера при температуре (t2).
5.2 Рассчитываем значение средней массовой изобарной теплоёмкости воздуха
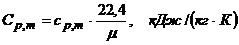 (6)
(6)
где коэффициент 22,4 нм3/кмоль – это объём одного киломоля идеального газа при нормальных условиях;
m - относительная молекулярная масса исследуемого газа;
для воздуха m= 28,96 кг/кмоль – кажущаяся молекулярная масса.
5.3 Рассчитываем значение средней мольной изобарной теплоёмкости воздуха

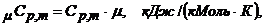 (7)
(7)
5.4 Рассчитываем теоретическую (табличную) среднюю мольную изобарную теплоёмкость воздуха в интервале температур проведения опыта
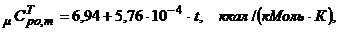 (8)
(8)
где 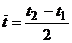 - среднее значение температуры воздуха в опыте;
- среднее значение температуры воздуха в опыте;
в свою очередь 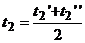 ,
,
где 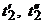 - значения температуры воздуха при выходе из калориметра в начале и в конце интервала времени выполнения опыта.
- значения температуры воздуха при выходе из калориметра в начале и в конце интервала времени выполнения опыта.
5.5. Рассчитываем относительную погрешность определения средней изобарной теплоемкости воздуха в индивидуальном опыте по сравнению с табличным значением 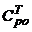 , m , рассчитаннымиз соотношения (8).
, m , рассчитаннымиз соотношения (8).
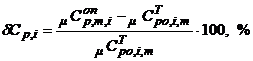 (9)
(9)
ВНИМАНИЕ!. Перед подстановкой величин в соотношение (9) необходимо их перевести в одинаковые единицы измерения.
В процессе выполнения лабораторной работы учащийся заполняет свой протокол лабораторной работы, заблаговременно подготовленный к началу соответствующих занятий. После окончательного оформления протокола лабораторной работы (выполнения всех предусмотренных расчетов) и проработки соответствующего теоретического материала, студент в индивидуальном порядке защищает работу. Правила защиты и учета результатов защиты в соответствующем модульном контроле уточняются преподавателем конкретно в начале лабораторного практикума.
Контрольные вопросы:
1. Дайте математическое и физическое определения понятиям «истинная и средняя теплоемкости вещества».
2. Значение какой теплоемкости (истинной или средней) можно рассчитать по измеряемым в работе параметрам? Поясните почему.
3. Какие величины, какими приборами и с какой конкретной целью измеряются в работе?
4. Дайте определение понятию «нормальные условия». В каких случаях они используются? Что означает величина с размерностью нм 3? Что означают величины 22,4 нм3 и 22,4 литра?
5. Дайте определение понятиям функция состояния и функция процесса. Теплоемкость является функцией процесса или функцией состояния?
6. В чем проявляется двойственность физической сущности теплоемкости с точки зрения основных понятий и определений термодинамики?
7. Как соотносятся (связаны) между собой массовая, объемная и мольная теплоемкости? Каковы их размерности в СИ?
8. В чем состоит отличие между понятиями «теплоемкость тела и удельная теплоемкость вещества»? Связаны ли они между собой?
9. Чему равны теплоемкости веществ в изотермическом и адиабатном (изоэнтропном) процессах?
10. Геометрический смысл средне и истинной теплоёмкости в процессе, изображенном в T,s координатах? Два свойства T,s диаграммы?
11. Запишите соотношения, связывающие значения изобарной и изохорной теплоемкостей.
12. От скольких и каких параметров зависят теплоемкости идеального и реального газов? От чего зависят изохорная и изобарная теплоемкости идеального газа по упрощенной МКТ?
13. Запишите соотношения для расчета изохорной и изобарной теплоемкостей идеального газа по упрощенной модели молекулярно-кинетической теории.
14. Выведите (запишите) соотношение для пересчета измеряемого в опыте расхода воздуха в нм 3.
15. Как построены таблицы средних значений теплоемкостей идеального газа? Запишите уравнения для расчета теплоты в процессе с использованием средних табличных теплоёмкостей.
16. От скольких и каких параметров состояния зависят теплоемкости реального и идеального газов? От чего зависит теплоемкость идеального газа по упрощенной модели молекулярно-кинетической теории?
 2018-01-08
2018-01-08 2307
2307








