Вывод закона Фарадея
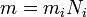 (1)
(1)
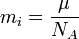 (2)
(2)
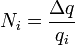 (3)
(3)
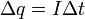 (4)
(4)
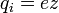 , где z — валентность атома (иона) вещества, e — заряд электрона (5)
, где z — валентность атома (иона) вещества, e — заряд электрона (5)
Подставляя (2)-(5) в (1), получим
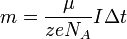
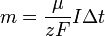
где 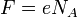 — постоянная Фарадея.
— постоянная Фарадея.
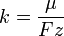
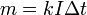
2 закон.
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
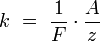
где 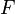 — постоянная Фарадея.
— постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
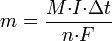
где 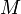 — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль;
— молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль; 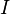 — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А;
— сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А; 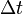 — время, в течение которого проводился электролиз, с;
— время, в течение которого проводился электролиз, с; 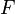 — постоянная Фарадея, Кл·моль−1;
— постоянная Фарадея, Кл·моль−1; 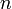 — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
— число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Применение. Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия, хлора, хлорорганических соединений[ источник не указан 1318 дней ], диоксида марганца[2], пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также, электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Электролиз с растворимым анодом. Электролиз с растворимым анодом.
В качестве растворимых электродов, анодов чаще всего принимаются Cu, Ni, Кобальт, олово.
Рассмотрим в качестве примера электролиз водного раствора сульфата кадмия с кадмиевыми анодом и катодом E0= - 0.4 В.
На катоде будут восстанавливаться ионы кадмия и молекулы воды. А на аноде окисляться материал электрода кадмий:
CdSO4 →Cd2++SO42-
(-)K 2H2O+ 2ē→2OH+H24, Cd2++ 2ē→Cd|1
(+)A Cd0-2ē→Cd2+ |2
2H2O+Cd2++2Cd0→2OH-+H2+2Cd2++Cd0.
Нерастворимым называется анод, материал которого не претерпевает окисления в ходе электролиза. На нерастворимом аноде при электролизе водных растворов щелочей и фторидов происходит электрохимическое окисление воды с выделением кислорода.
Вопрос 47.
Коррозия металлов — разрушение металлов вследствие химического или электрохимического взаимодействия их с коррозионной средой. Для процесса коррозии следует применять термин «коррозионный процесс», а для результата процесса — «коррозионное разрушение». Образование гальванических пар с пользой применяют для создания батарей и аккумуляторов. С другой стороны, образование такой пары приводит к неблагоприятному процессу, жертвой которого становится целый ряд металлов, — коррозии. Под коррозией понимают происходящее на поверхности электрохимическое или химическое разрушение металлического материала. Наиболее часто при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии. Коррозия может быть вызвана как химическим, так и электрохимическим процессом. Соответственно, различают химическую и электрохимическую коррозию металлов.
Химическая коррозия — взаимодействие поверхности металла с коррозионно-активной средой, не сопровождающееся возникновением электрохимических процессов на границе фаз. В этом случае взаимодействия окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом:
4Fe + 3O2 → 2Fe2O3
При электрохимической коррозии ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала металла (например, ржавление стали в морской воде).
Электрохимическая коррозия. Электрохимическая коррозия возникает при контакте металла с окружающей электролитически проводящей средой. При этом восстановление окислительного компонента коррозионной среды протекает не одновременно с ионизацией атомов металла и от электродного потенциала металла зависят их скорости. Первопричиной электрохимической коррозии является термодинамическая неустойчивость металлов в окружающих их средах. Ржавление трубопровода, обивки днища морского суда, различных металлоконструкций в атмосфере - это, и многое другое, примеры электрохимической коррозии.
К электрохимической коррозии относятся такие виды местных разрушений, как питтинги, межкристаллитная коррозия, щелевая. Кроме того процессы электрохимической коррозии происходят в грунте, атмосфере, море.
В отличии химического, электрохимические процессы контролируются (зависят) не только от концентрации реагирующих веществ, но и, главным образом, зависят от потенциала поверхности металла.На границе раздела двух разнородных фаз происходит переход заряженных частиц - ионов или электронов из одной фазы в другую, следовательно, возникает разность электрических потенциалов, распределения упорядоченных электрических зарядов, т.е. образование двойного электрического слоя.
Коррозия оцинкованного железа. Кислая среда. В пробирку опускаем кусочек оцинкованного железа. Наблюдение: Железо, покрытое цинком, наблюдается выделение пузырьков, синее окрашивание.Вывод: В кислом растворе происходит коррозия оцинкованного железа.
Нейтральная среда: При коррозии железа на аноде протекает следующий процесс- На катодных участках поверхности в нейтральных и щелочных средах осуществляется процесс ионизации кислорода, растворенного в электролите или в тонкой пленке влаги.
Схема коррозии оцинкованного железа
К железу-катоду будут подходить ионы водорода (вода) и разряжаться, принимая электроны. Образующиеся атомы водорода объединяются в молекулу H2. Таким образом, потоки ионов будут разделены и это облегчает протекание электрохимического процесса. Растворению (коррозии) будет подвергаться цинковое покрытие, а железо до поры до времени будет защищено. Цинк электрохимически защищает железо от коррозии. На этом принципе основан протекторный метод защиты от коррозии металлических конструкций и аппаратов. Английское слово «претект» – означает защищать, предохранять. При протекторной защите к конструкции, к аппарату через проводник электрического тока присоединяется кусок более электроотрицательного металла. Его можно поместить прямо в паровой котел.
При наличии влаги, а точнее в присутствии электролита начнет действовать гальванический элемент. В нем будет растворяться более электроотрицательный металл, а конструкция или аппарат оказываются катодно защищенными. Защита будет действовать до тех пор, пока полностью не растворится анод – более электроотрицательный металл.
Вероятно, впервые катодную защиту применил знаменитый английский ученый Дэви (1824). Для защиты медной облицовки морских судов он рекомендовал использовать «жертвенные» аноды из железа, которые присоединялись снаружи к корпусу судна. Скорость коррозии медной облицовки в морской воде при этом, действительно, значительно снизилась. Однако вместо одной неприятности появилась другая. Ионы меди Cu2+ являются биоцидными (ядовитыми) для микроорганизмов. Поскольку медный корпус оказался защищенным и ионы меди перестали переходить в морскую воду, то корпус оказался беззащитным от микроорганизмов. Они стали поселяться на корпусе судна, что приводило к обрастанию ракушками. В результате скоростные характеристики судна значительно снизились. Периодическая очистка днища судна от ракушек стоила больших затрат.
С протекторной защитой весьма сходна катодная защита металлов от коррозии. Можно сказать, что катодная защита является модификацией протекторной защиты. В данном случае конструкция или корпус корабля присоединяются к катоду источника постоянного тока и тем самым защищаются от растворения.
При наличии дефектов на белой жести процесс коррозии существенно иной, чем оцинкованного железа. Поскольку олово электроположительнее железа, то растворению подвергается железо, а катодом становится олово (рис. 3). В результате при коррозии слой олова сохраняется, а под ним активно корродирует железо.
Способы защиты металлов от коррозии. Одним из наиболее распространенных способов защиты металлов от коррозии является нанесение на их поверхность защитных пленок: лака, краски, эмали, других металлов. Качество покрытия зависит от тщательности подготовки поверхности и способа нанесения защитного слоя. Для защиты металлов от коррозии используют стекловидные и фарфоровые эмали – силикатные покрытия, коэффициент теплового расширения которых должен быть близок к таковому для покрываемых металлов. Эмалирование осуществляют нанесением на поверхность изделий водной суспензии или сухим напудриванием. Так же используют цементные покрытия.
Вопрос 48.
Коррозия бетона и меры борьбы с ней
Виды коррозии бетона в жидкой среде.
|
КОРРОЗИЯ ФИЗИЧЕСКАЯ. — Прямое физическое растворение без химических реакций
Физическая коррозия
Это выветривание, растворение, разрушение вследствие температурных колебаний характерных для всех видов горных пород
Физическая коррозия — разрушение из-за кристаллизации солей, наличия в грунте более 1 % вода растворимых солей или высокого уровня грунтовых вод с минерализацией не менее 3000 мг/л. Физическая коррозия может происходить и в результате водной сорбции.
Химическая коррозия — взаимодействие поверхности металла с коррозионно-активной средой, не сопровождающееся возникновением электрохимических процессов на границе фаз. В этом случае взаимодействия окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте.
Магнезиальная коррозия. Если в окружающей цементный камень среде содержатся вещества, образующие с Са(ОН)2 малорастворимые соединения, то концентрация извести в ней будет поддерживаться на очень низком уровне.
Например, если в пластовых водах есть MgSO4, то он вступая во взаимодействие с Са(ОН)2 по реакции:
Са(ОН)2 + MgSO4 + 2Н2О = Mg(ОН)2 + Са SO4+ 2Н2О
Mg(ОН)2 и гипс имеют очень низкую растворимость в воде. Mg(ОН)2 сам по себе представляет рыхлое аморфное вещество. Если подобный процесс будет продолжаться - цементный камень разрушится. Это магнезиальная коррозия. Подобное действие но более слабое, оказывает и хлористый магний.
Углекислотная коррозия. Са(ОН)2 + СО2 = СаСО3 + Н2О СаСО3 + Н2О + СО2 = Са(НСО3)2
Углекислотная коррозия.
В пластовых водах как правило присутствует то или иное количество углекислого газа. Он действует разрушающе, поскольку понижает содержание Са(ОН)2 окисляя ее сначала до СаСО3, которая мало растворима, что будет вызывать понижение основности гидратов цемента. При поступлении новых порций СО2, СаСО3 окисляется до бикарбоната Са (НСО3)2, который хорошо растворим. При незначительной концентрации Са2 в водах процесс может затухнуть. Однако если кислота содержится в пластовом газе, то вследствие большой проницающей способности, диффузии и осмоса возможно быстрое разрушение камня. Если процесс ограничивается до СаСО3, то низкоосновные, если до Са (НСО3)2 - т о высокоосновные.
Сульфатная коррозия бетона — коррозия бетона в результате взаимодействия цементного камня с сульфатами. Сульфатная коррозия возникает при действии на цементный камень бетона сульфатных вод. Сульфаты CaS04, MgS04, Na2S04 и др. входят в состав большинства природных грунтовых, а также сточных вод. В результате обменной реакции сульфатов с гидроксидом кальция в порах цементного камня образуется двуводный сернокислый кальций (гипс), который взаимодействует с гидроалюминатом кальция:
2(CaS04 +2Н20) + ЗСаО +А1203 + 6Н20 + 19Н20 = ЗСаОА1203 -3CaS04 + 31Н20
Образующийся при этом труднорастворимый гидросульфоалюминат кальция.
Вопрос 49.
Мета́ллы-группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса.
Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите. Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Гладкая поверхность металлов отражает большой процент света — это явление называется металлическим блеском. Однако в порошкообразном состоянии большинство металлов теряют свой блеск; алюминий и магний, тем не менее, сохраняют свой блеск и в порошке. Наиболее хорошо отражают свет алюминий, серебро и палладий — из этих металлов изготовляют зеркала. Для изготовления зеркал иногда применяется и родий, несмотря на его исключительно высокую цену: благодаря значительно большей, чем у серебра или даже палладия, твёрдости и химической стойкости, родиевый слой может быть значительно тоньше, чем серебряный.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
 2018-01-21
2018-01-21 661
661







