концентрирование, восстановление и рафинирование (очистку).
Концентрирование. Многие руды содержат нежелательные материалы, например глину или гранит. Эти нежелательные материалы называются пустая порода. Таким образом, первая стадия извлечения металла заключается в удалении пустой породы. Этот процесс называется концентрированием. Физические методы отделения пустой
Пузырьки концентрата медной руды на поверхности флотационного бака (завод в Папуа, Новая Гвинея).породы включают флотацию и магнитное разделение. Концентрирование по методу флотации проводится так: руду мелко размалывают и затем смешивают с маслом и водой в большом баке. Эту смесь вспенивают, пропуская через нее поток воздуха. Масляная пена захватывает необходимый минерал и всплывает к верхнему краю бака, откуда ее снимают.
Магнитное разделение используется для отделения магнетита Fe3O4 от пустой породы. Оно проводится с помощью электромагнита.
Химические способы извлечения металлов включают выщелачивание их руд, т.е. экстракцию металла в составе какой-либо его растворимой соли из приготовленного для этой цели водного раствора. Например, для выщелачивания руд, содержащих оксид меди(Н), может использоваться разбавленная серная кислота.
Восстановление. что большинство металлов существуют в природе в окисленной форме. Например, натрий существует в виде ионов Na*, входящих в такие соединения, как хлорид натрия, а олово-в виде SnO2- Вторая стадия извлечения металлов заключается в восстановлении их руд до металлического состояния. С этой целью используются различные методы. Металлы, существующие в природе в виде оксидных руд, могут быть восстановлены без предварительной химической обработки, при помощи углерода или оксида углерода. Рафинирование. Рафинирование (очистка) представляет собой последнюю стадию извлечения металлов. Для ее проведения используются различные методы, в том числе перегонка и электролиз.
Способы получения металлов из руд
Руда – скопление металлсодержащих минералов, входящих в состав горных пород. Руды – главный источник получения металлов. Предварительно их освобождают от пустой породы (обогащают), а затем путем восстановления извлекают металл.
Для восстановления металлов из руд используют различные процессы и восстановители.
1) Пирометаллургия – восстановление металлов из руд, содержащих металлы в виде оксидов, хлоридов, сульфидов, при высоких температурах.
В зависимости от типа восстановителя различают:
а) Металлотермия – восстановитель – более активный металл.
Если в качестве восстановителя применяется алюминий, процесс называется алюминотермией. Алюминотермию используют для получения из оксидов тугоплавких и дорогих металлов: V, Mo, Mn, Cr
Cr2O3 + 2Al → Al2O3 + 2Cr,
Магниетермия – получение металлов из хлоридов при помощи восстановителя магния:Ti, Zr, Nb, Ta.
TiCl4 + 2Mg = Ti + 2MgCl2
б) Карботермия – восстановление металлов из оксидов углеродом. Используется для получения малоактивных металлов - Fe, Cu, Zn, Pb. Процесс идет в 2 стадии:
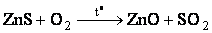 – обжиг сульфидов,
– обжиг сульфидов,
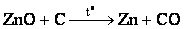 – восстановление.
– восстановление.
в) гидротермия –восстановление металлов из оксидов водородом:
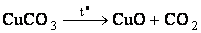 – разложение карбонатов,
– разложение карбонатов,
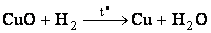 – восстановление водородом.
– восстановление водородом.
2) Гидрометаллургия – получение металлов из руд в виде соединений водных растворов с помощью различных реагентов с последующим выделением металла из раствора. Процесс идет при обычных температурах. Восстановители – активные металлы или электроны.
Гидрометаллургическим способом получают золото.
Из руд золото извлекают с помощью цианида калия в виде K[Au(CN)2], а затем проводят восстановление порошкообразным цинком:
2K[Au(CN)2] + Zn → K2[Zn(CN)4] + 2Au
Обычно получаемый металл находится в мелкораздробленном состоянии.
3) Электрометаллургия - получение металлов из водных растворов или расплавов электролизом.
а) Электролиз водных растворов используют для получения малоактивных металлов:
CuSO4 + H2О → Cu° + H2SO4 + O2↑
(-) катод: Cu2+ + 2e‾ → Cu0
(+) анод: 2Н2О – 4е → О2↑ + 4Н+;
2Н+ + SO42- → H2SO4
б) Электролиз расплавов – для получения активных металлов – щелочных и щелочноземельных, алюминия.
2NaClрасплав → 2Na° + Cl2↑
(-) катод: Na+ + 1e‾ → Na0
(+) анод: 2Cl – 2e‾ → Cl2
 2018-01-21
2018-01-21 3109
3109
