Катализ – ускорение химической реакции за счет введения в реакцию специальных веществ, катализаторов.
катализатор – вещество ускоряющее реакцию, но не расходующееся.Катализатор не снижает исходную энергию веществ и продуктов реакции.Гомогенный – реагирующие вещества и катализатор в одном агрегатном состоянии. Гетерогенный – реагирующие вещества и катализатор в разных агрегатных состояниях. (тесно связан с адсорбцией(экзотермический процесс самопроизвольного концентрирования вещества из объема фаз на поверхности раздела между ними)Механизм действия катализатора: основное объяснение – это образование промежуточных продуктов при взаимодействии катализатора и реагирующего вещества. Много стадийность реакций приводит к понижению энергии активации и увеличению скорости реакции.
26 вопрос Растворимость веществ в воде. Способы выражения концентрации растворенного вещества (массовая доля, мольная доля, молярностъ, моляльность, нормальность, титр)
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
(Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах. W=m1/m2 где: m1 — масса растворённого вещества, г; m — общая масса раствора, г). (Мольная (молярная) доля вещества — концентрация, выраженная отношением числа молей вещества к общему числу молей всех веществ, имеющихся в растворе.)(Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным. m = V/m2 где:ν — количество растворённого вещества, моль;m2 — масса растворителя, кг.)Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н. Титр раствора — масса растворённого вещества в 1 мл раствора.
T=m1/V Где: m1 — масса растворённого вещества, г; V — общий объём раствора, мл;
Вопрос 27. коллегиальные свойства р-ров зависят в 1 очередь от концентрации р-ров
1з. Рауля: Р(давл.)(воды)-Р(р-ров)=Рводы*N Р(Н2О)-давление насыщенного пара чистой воды. Р(р-р)-давление пара воды р-ля. N-мольная доля р-го в-ва. Динамическое равновесие, т.е. сколько пара молекул воды ушло, столько и вернулось. Такое давление называется давление насыщенного пара при постоянной температуре. 2з.Рауля: повышение т.кип и понижение т.замерзания р-ров(разбавленных) прямо пропорционально мольной концентрации р-ров. ∆Тз.=К*Сm, ∆T=E*Cm. ∆Т-разница между тем.кип чистой воды и р-ра.Е-константа.2з.Рауля используют на практике для определения молярных масс р-го в-ваСm=m(в-ва)*1000/M(в-ва)*m(H2O).Осмос – это одностороннее проникновение молекул р-ля(Н2О) через полупроницаемую мембрану р-ра С меньшей концентрации в-ва. Если полупроницаемой мембраны нет, то и осмоса не будет. Движущая сила осмоса – это стремление системы выровнять концентрации р-ров. Осмос – явление самопроизвольное. Осмотическое давление – это минимальное гидравлическое давление которое нужно приложить к р-ру, чтобы осмос прекратился. Уравнение вант-Гоффа Р(осмос)=С*R*T Т-температура, С-молярная концентрация. Р-ры с одинаковыми осмотическими давлениями –изотоническое; Р-р с большим ос. Давл-гипертонический. Коллигативные свойства – это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят:1) понижение давления насыщенного пара растворителя над раствором,2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей. 3) осмотическое давление.
Вопрос 28. ТЭД:1)молекулы в-в в р-рах могут распадаться на (-)и(+) заряженные ионы,т.е. диссонируют. Отрицательные ионы двигаются к положительному электроду(аноду)2)Процесс диссоциации процесс обратимый, в р-х тв. В-в диссоциацию вызывает высокая температура. Степень диссоциации(α)=n-число молеулраспавшихся на ионы/N- общее число мролекул. По степени диссоциации е делятся на 3 группы: 1)Если α>30%-это сильные е.2)если α<3%-это слабые е.3)если 3< α<30. К=((Кат^+m)^n*(An^-n)^m)/(KatnAnm)^1 – константа диссоциации.
Вопрос 29 Диссоциация воды. Вода слабый электролит НОН↔Н++ОН-. К дис=(Н+)*(ОН-)/(Н2О)=1,8*10^-6. Найдем равновесную концентрацию воды: Берем 1000грН2О/Mr=1000/18=55,6 моль/л. (Н+)*(ОН-)*55,6=10^-4 – ионное произведение воды. Водородный показатель рН=-lg(H+)/Mr(H+), H+=10^-3моль/л ОН+10^-11(моль/л).рН+рОН=14. Диссоциация воды
Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды распадаться (диссоциировать) на два иона которые и являются проводниками электрического тока в чистой воде
H2O ↔ H+ + OH-
Диссоциация обратима, то есть ионы H+ и OH- могут снова образовать молекулу воды. В итоге наступает динамическое равновесие при котором количество распавшихся молекул равно количеству образовавшихся из H+ и OH- ионов. Другими словами скорости обоих процессов будут равны.
30 вопросОкисли́тельно-восстанови́тельныереа́кции, ОВР В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.Окисление - процесс отдачи электронов, с увеличением степени окисления.При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель.В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, т.е. восстановлением, другая — с отдачей электронов, т.е. окислением.Виды окислительно-восстановительных реакцийМежмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:Н2S + Cl2 → S + 2HClВнутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молкулах одного и того же вещества, например:2H2O → 2H2 +
31 вопросМетод электронного баланса — один из методов уравнивания окислительно-восстановительных реакций (ОВР).Заключается в том чтобы на основании степеней окисления расставить коэффициенты в ОВР.Для правильного уравнивания следует придерживаться определённой последовательности действий:Найти окислитель и восстановитель.Составить для них схемы (полуреакции) переходов электронов, отвечающие данному окислительно-восстановительному процессу.Уравнять число отданных и принятых электронов в полуреакциях.Просуммировать порознь левые и правые части полуреакций.Расставить коэффициенты в уравнении окислительно восстановительной реакции. Метод полуреакций или метод ионно-электронного баланса применяют при составлении уравнений сложных реакций, протекающих в водных растворах или расплавах. Стехиометрические коэффициенты находят при составлении схемы полуреакций для процессов окисления и восстановления. Напомню, что в методе электронного баланса записываются только атомы, которые меняют свои степени окисления. Для составления записи в методе полуреакций используют реальные частицы – атомы, молекулы, ионы, а также частицы, характеризующие среду (кислую – Н+, щелочную – ОН-, нейтральную – H2O). Сильные электролиты записывают в виде ионов, а слабые электролиты, газообразные вещества и труднорастворимые соединения – в виде молекул.При нахождении коэффициентов в уравнении реакции руководствуются правилами:- Если исходные вещества содержат большее число атомов кислорода, чем полученные продукты, то освобождающийся кислород в кислой среде с ионами водорода образует воду, а в нейтральной и щелочной средах с молекулами воды – гидроксид-ионы,- Если исходные вещества содержат меньшее число атомов кислорода, чем образующиеся, то недостающее число атомов кислорода восполняется в кислой и нейтральной средах за счет молекул воды, а в щелочной – за счет ионов ОН-. Эквивалентом окислителя (восстановителя) называется такое его количество, которое восстанавливаясь (окисляясь), присоединяет (высвобождает) 1 моль электронов.
32 вопрос Гальванические элементы. ЭДС гальванического элемента. Гальванический элемент – это химический источник тока однократного использования, в котором окислитель и восстановитель входят в состав элемента и расходуются в результате его работы. Причиной возникновения в ГЭ электрического тока есть разность электродных потенциалов. Принцип действия: (на примере ZnCu разделенных KCl) электрический контакт между растворами обеспечивает KCl) При контакте Zn и Cu с раствором возникает хим равновесие. 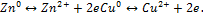 При замыкании цепи начинается движение электронов. Катодный процесс
При замыкании цепи начинается движение электронов. Катодный процесс 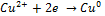 Анодный процесс
Анодный процесс 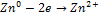 Чтобы определить направление движения электронов надо сравнить значения потенциалов (табл)ЭДС =
Чтобы определить направление движения электронов надо сравнить значения потенциалов (табл)ЭДС = 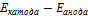 (Вольт)
(Вольт)
 2018-01-21
2018-01-21 607
607








