· Слабые электролиты диссоциируют не полностью и в их растворах устанавливается равновесие между процессом диссоциации и обратным процессом:
CH3COOH <=> CH3COO- + H+
· К процессу диссоциации слабых электролитов можно применить закон действующих масс и вывести константу диссоциации (константу равновесия):

C – общая концентрация кислоты
А – степень диссоциации
Са – концентрация каждого из ионов
С-Са – концентрация недиссоциированных молекул
· Следовательно:

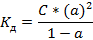
· Данное выражение является математическим выражением закона разведения Оствальда для слабого бинарного электролита
· Степень диссоциации слабых электролитов очень мала, поэтому ею можно пренебречь в знаменателе и получить более упрощенное математическое выражение закона разведения Оствальда:
Степень диссоциации слабого электролита обратно пропорциональна концентрации.
Степень диссоциации слабого электролита прямо пропорциональна разведению.

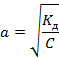
Диссоциация воды. Ионное произведение воды, pHи pOH
· Вода – вещество с малой степенью ионизации, поэтому к процессу ее диссоциации можно применить закон действующих масс:
Н2О ↔H+ + OH-



PHи pOH
· От величины рН зависит поведение клеток и их биологическая активность
· Отклонение значения рН биологических жидкостей от нормы может стать причиной тяжелых заболеваний
· Обменные процессы в организме совершаются в водных средах, вода и продукты ее диссоциации – ионы водорода и гидроксид-ионы – являются необходимыми факторами, определяющими структуру и биологические свойства белков, нуклеиновых кислот и других клеточных компонентов.
 2018-01-21
2018-01-21 1444
1444








