Для того чтобы определить строение молекулы методом Гиллеспи предлагается следующий порядок действий.
1. На основании формулы молекулы определяется число лигандов n, с которыми центральный атом образует связь и записывается формула AХnEm с указанием значения n.
2. Находится общее число связывающих и неподелённых электронных пар (n + m) по формуле:
(n + m) = 1/2 (Nц +  Nл – z) –
Nл – z) –  ,
,
где Nц – число электронов центрального атома на его внешнем электронном слое,  Nл – число электронов лигандов, участвующих в образовании связей с центральным атомом,
Nл – число электронов лигандов, участвующих в образовании связей с центральным атомом,  – число
– число  -связей в молекуле, z – заряд иона (в случае определения строения молекулярного аниона).
-связей в молекуле, z – заряд иона (в случае определения строения молекулярного аниона).
3. Определяется пространственное расположение всех электронных пар (связывающих и неподелённых).
4. Находится число неподелённых электронных пар m и уточняется формула молекулы AХnEm (указывается значение m).
5. Устанавливается геометрия молекулы.
Вопрос 18) Эффективные заряды атомов в молекулах. Дипольный момент связи, дипольный момент молекул. Дипольный момент молекулы и её строение на примерах ….
ЭФФЕКТИВНЫЙ ЗАРЯД АТОМА, характеризует разность между числом электронов, принадлежащих данному атому в хим. соед., и числом электронов своб. атома. Для оценок эффективного заряда атома используют модели, в к-рых экспериментально определяемые величины представляют как ф-ции точечных неполяризуемых зарядов, локализованных на атомах; напр., дипольный момент двухатомной молекулы рассматривают как произведение эффективного заряда атома на межатомное расстояние. В рамках подобных моделей эффективные заряды атомов можно рассчитать, используя данные оптич. или рентгеновской спектроскопии, ЯМР и др. Однако, поскольку электронная плотность в хим. соед. делокализована и границ между атомами не существует, нельзя описать разл. характеристики соед. одним набором эффективных зарядов атомов; значения этого показателя, определенные разными эксперим. методами, могут не совпадать. Эффективные заряды атомов можно определить также на основе квантовохим. расчетов.
Мера полярности связи – её дипольный момент (  ) – определяется произведением
) – определяется произведением
 = q l,
= q l,
где q – эффективный заряд, l – длина диполя (расстояние между двумя равными по величине и противоположными по знаку зарядами +q и –q).
Дипольный момент – это векторная величина. Понятия “дипольный момент связи” и “дипольный момент молекулы” совпадают только для двухатомных молекул. Дипольный момент сложной молекулы равен векторной сумме дипольных моментов всех связей. Дипольный момент многоатомной молекулы зависит не только от полярности отдельных связей в молекуле, но и от геометрической формы молекулы.
Например, в линейной молекуле СО2 каждая из связей С–О полярна, а молекула в целом неполярна
(  (СО2)=0), так как дипольные моменты связей компенсируют друг друга (рис. 8.1). В угловой молекуле Н2О связи расположены под углом 104,5o и векторная сумма дипольных моментов
(СО2)=0), так как дипольные моменты связей компенсируют друг друга (рис. 8.1). В угловой молекуле Н2О связи расположены под углом 104,5o и векторная сумма дипольных моментов  двух связей выражается диагональю параллелограмма (рис. 8.1). Если
двух связей выражается диагональю параллелограмма (рис. 8.1). Если  ¹ 0, то молекула полярна.
¹ 0, то молекула полярна.
Что важно – чем симметричнее молекула, тем меньше ее μ, например симметричные молекулы (CO2; BCl3; CCl4; PCl5; SF6) неполярны и имеют μ=0.
Вопрос 19) Основные положения метода молекулярных орбиталей (МО ЛКАО). Объясните парамагнитные св-ва … и найдите кратность связи в … и …
Основные положения метода МО:
1) е заселяются вместе в соответствии с принципом Паули: на 1 орбитали не более не более 2-х е)
и правилом Хунда: при наличии орбитали с одинаковой энергией эти орбитали заселяются сначала по 1 е
2) Каждый разрыхляющий е сводит на нет действие связующего электрона. Если разрых е больше или столько же, сколько связующих,то молекула не образуюется. Кр св = (число е(связ)- число е (разрых))/ 2
3) ММО позволяет определить магнитные свойства молекулы: если молекула имеет неспаренный электрон,то она является парамагнетиком, такая частица выталкивается из магнитного поля, частица, имеющая неспаренный электрон называется радикалом, они химически активны и ядовиты. Молекулы, у которых все е спарены, явл диамагнетиками, они не реагируют на магнитное поле.
Энергетический ряд МО

Вопрос 20) Основные положения метода валентных связей при описании химической связи в комплексных соединениях. Рассмотрите на примерах … и …
Согласно МВС при образовании КС возникает д/а связь за счет неподеленной электронной пары лигандов и свободных квантовых ячеек комплексообразователя. При этом орбитали комплексообразователя подвергаются гибридизации. В случае sp гибр – правильный треугольник, sp3 - тетраэдр, dsp2 – квадратная молекула, dsp3 – тригональная бипирамида, d2sp3 - октаэдр. Свободные пары е, которыми обладают лиганды, заполняют пустые орбитали центрального иона. Эти орбитали объединяют в гибридные комбинации в зависимости от координационного числа (к.ч).
Вопрос 21) Основные положения теории кристаллического поля при описании химической связи в комплексных соединениях. Рассмотрите на примерах … и …
Основные положения:
1. связь между к/о и лигандами рассматривается как электростатическая.
2. Лиганды считаются точечными ионами или точечными диполями, их электронное строение игнорируется.
3. Лиганды и к/о считаются жестко закрепленными.
4. Подробно рассматривается электронное строение к/о.
Вопрос 22) Эквиваленты в-в в реакциях обмена (или в окислительно – восстановительных реакциях). Фактор эквивалентности, молярная масса эквивалента, молярный объём эквивалента. Приведите три примера. Закон эквивалентов.
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н+ (одному иону ОН- или единичному заряду), а в данной окислительно-восстановительной реакции эквивалентна одному электрону. Иными словами, эквивалент – это часть молекулы, приходящаяся на один электрон в данной ОВР или на один протон (один гидроксил, единичный заряд) в данной обменной реакции.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества. Эта величина меняется от нуля до единицы.
1 моль экв. содержит 6,02.1023 эквивалентов, а его масса в граммах и будет молярной массой эквивалента: Мэкв = fэкв.M.
Молярный объём эквивалента – это объём, который занимает 1 моль экв. в-ва при нормальных условиях.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е. (Числа эквивалентов веществ, вступивших в реакцию, и образовавшихся в результате реакции, равны)
nэкв(А)= nэкв(В)= nэкв(С)= nэкв(D)
Пример: O2(0)----+4e----2O(-2)
Fэкв =1/4; Mэкв = M* fэкв = 34*1/4 = 8г/моль; Vэкв = Vm*fэкв = 22,4*1/4=5,6 л/моль*экв
Вопрос 23) Закон эквивалентов. Различные формы записи закона (реакции в-в в растворах, реакции в-в в газообразном состоянии). Что такое нормальная концентрация и как она связана с молярной концентрацией?
Вопрос 22
1 моль экв. содержит 6,02.1023 эквивалентов, а его масса в граммах и будет молярной массой эквивалента: Мэкв = fэкв.M. Число молей эквивалентов каждого из участников процесса может быть найдено следующим образом: 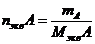 ;
;  , где mA и mB – массы в-в А и B. И поэтому другая запись закона эквивалентов имеет: “число молей эквивалентов участников данного процесса есть постоянная величина”: nэкв.A = nэкв.B = nэкв.C = … = const.
, где mA и mB – массы в-в А и B. И поэтому другая запись закона эквивалентов имеет: “число молей эквивалентов участников данного процесса есть постоянная величина”: nэкв.A = nэкв.B = nэкв.C = … = const.
Если участники процесса находятся в растворе, то число молей эквивалентов каждого из них может быть найдено умножением нормальной концентрации в-ва на объём его раствора. В результате для этого частного случая закон эквивалентов принимает форму: 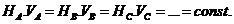
Для химических расчетов с участием газов наряду с молярными массами активно использует величина 22,4 л (объём 1 моль газа при нормальных условиях). Аналогично вводится:  .
.
Нормальная концентрация (нормальность) н раствора показывает сколько моль эквивалентов растворенного в-ва содержится в 1 л раствора.
n р.в моль экв = Сн * V рас-ра
Связь между Сн и См:  при fэкв < 1 Сн > См
при fэкв < 1 Сн > См
Вопрос 24) Классификация окислительно – восстановительных реакций. Преведите по 2 примера реакций каждого типа (не используйте уравнения из задания №5).
Классификация ОВР:
I группа – реакции межатомного и межмолекулярного окисления, восстановления – это реакции, в которых обмен е происходит между различными атомами, молекулами или ионами.
2Ca+ O2 à 2CaO
2KBr+ Cl2 àBr2+ 2KCl
2) II группа – реакции диспропорционирования. В реакциях диспропорционирования молекулы или ионы одного и того же вещества реагируют друг с другом, как восстановитель и окислитель.
например: (N-3H4)2Cr+62O7 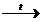 N02 + Cr+32O3 + 4H20.
N02 + Cr+32O3 + 4H20.
Сl2 + 2NaOH àt NaCl + NaClO+H2O
3Cl2+ 6NaOH à 5 NaCl + NaClO3 + 3H2O
3)III группа - реакции внутримолекулярного окисления, восстановления, в которых окислитель и восстановитель находятся в одной молекуле: 2KClO3 à 3O2 + 2KCl
4) IV группа – реакции контрдиспропорционирования. Реакции, которые протекают между одним и тем же элементом, в положительном и отрицательном степени окисления, образуется промежуточн. ст. окисления
2H2S + SO2 à 3S + 2H2O
(N3-H4)2N3+O2 = N20 + H2O
Вопрос 25) Типичные восстановители в ОВР. Каковы продукты их окисления? Приведите примеры. Классификация ОВР.
Восстановитель – вещество, молекулы или ионы которого отдают электроны. Типичные восстановители:
Атомы Ме, ионы неМе, положительно заряж. ионы неМе, Ме, котоые отдают электроны. 1 группа: Fr Cs K Na Li Ba Sr Ca Mg
2 группа: Br (-) S (2-) Cl(-) I (-) Se(2-)
3 группа: SO3 NO2 SnO2
4 группа: Sn Fe Cr Mn катионы металлов в низких степенях окисления
5 группа: H2 C N2H2 CO SO2
Аммиак и соединения аммония.
HCl(только конц) KBr NaI CuS(2-)
Продукты их окисления: если элемент является восстановителем – его степень окисления повышается.
Al(0)àAl(+3)
Zn(0)à Zn(+2)
Fe(+2) à Fe(+3)
Нитрит в нитрат
Сульфит в сульфат
NH3àв N2 или HNO3(или соли)
S(2-) à S(0) SO4 (кис-та или соли)
HHal à Br2 I2 Cl2
(HBr HI HCl(к)
HNO2 à обычно в NO
Классификация 25 вопрос
Примеры:
2KMnO4+ 10KBr (восстановитель) + 8H2SO4 à 2MnSO4 + 5Br2+ 6K2SO4 +8H2O
KMnO4 + 16HCl à 5Cl2+2 MnCl2 + 2KCl +8H2O
Вопрос 26) Типичные окислители в ОВР. Каковы продукты их восстановления? Классификация ОВР. Приведите примеры.
Окислитель – вещество, молекулы или ионы которого принимают электроны. Типичные окислители:
1) в-ва, молекулы которых содержат атомы элементов в высших положительных степенях окисления, например: KMn+7O4, KBi+5O3, K2Cr2+6O7, Pb+4O2; хроматы, дихроматы,манганаты
2) катионы металлов более высокого заряда (более высокой степени окисления), например: Fe+3; Au+3; Sn+4;
3) галогены и кислород (при повышенных температурах).
H2O2, H2SO4(к), HNO3
Кислородосодержащие соли галогенов или соли кислоты (NaClO4 KClO3 HClO)
Классификация ОВР: вопрос 24
Продукты их восстановления: Если элемент является окислителем – его степень окисления понижается; Среди простых веществ окислительные свойства характерны для типичных неметаллов (F2, Cl2, Br2, I2, O2, O3). Галогены, выступая в качестве окислителей, приобретают степень окисления –1, причем от фтора к иоду окислительные свойства ослабевают. Кислород, восстанавливаясь, приобретает степень окисления –2 (H2O или OH–).
Концентрированная серная кислота проявляет окислительные свойства за счет серы в высшей степени окисления +6. Концентрированная H2SO4 в реакциях с металлами может восстанавливаться до SO2, S или H2S. Состав продуктов восстановления определяется активностью металла, концентрацией кислоты и температурой. При обычной температуре концентрированная серная кислота не реагирует с такими металлами, как железо, хром и алюминий (явление пассивации), а при нагревании H2SO4 не реагирует с золотом и платиной. Малоактивные металлы, стоящие в ряду стандартных электродных потенциалов правее водорода, восстанавливают концентрированную серную кислоту до SO2. Активные металлы (Ca, Mg, Zn и др.) восстанавливают концентрированную серную кислоту до свободной серы или сероводорода.
Продукты восстановления KMnO4 зависят от рН среды, в которой протекают реакции:
В кислой à соли Mn(+2) и соль К+
В щелочной à K2MnO4
В нейтральной à MnO2 + KOH
Дихромат, хромат калия K2Cr2O7 в кислой среде (H2SO4) восстанавливается до Cr2(SO4)3. В щелочной среде в Cr(OH)3 или комплексы.
HNO3 (р) в основном в NO,а концентрированная в NO2.
KClO4 NaBrO3 KClO2 в бескислородные соли KCl NaBr
Галогены в Cl- Br- I- (кислоты или соли)
Примеры:
2KMnO4 (окислитель) + 5Na2SO3 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O;
K2Cr2O7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 +3Fe2(SO4)3 + K2SO4 + 7H2O.
4Ca + 5H2SO4(конц) = 4CaSO4 + H2S + 4H2O.
S + 2H2SO4(конц) = 3SO2 + 2H2O
FeO + 4HNO3(конц) = Fe(NO3)3 + NO2 + 2H2O;
C + 4HNO3 (конц) = CO2 + 4NO2+ 2H2O;
Вопрос 27) Общие сведения о комплексных соединениях: комплексообразователь, лиганды, координационное число, внутренняя и внешняя сферы. Классификация комплексных соединений. Приведите примеры.
Соединения высшего порядка, образованные из более простых устойчивых химических форм (молекулах, ионов, атомов), называют комплексными соединениями.
Центральный ион (атом) в компл. соединении наз. комплексообразователем. (ион d– или f–элемента, реже p– или s–элемента).
Непосредственно окружающие к/о ионы или молекулы, называемые лигандами, образуют вместе с к/о внутреннюю (координационную) сферу (выделяется [ ]).
Ионы (молекулы) за пределами внутренней сферы образуют внешнюю сферу компл. соединения.
Общее число лигандов во внутр. сфере называется координационным числом.
Классификация комплексных соединений. Приведите примеры: см. вопрос 28.
Вопрос 28) Классификация комплексных соединений: по виду координируемых лигандов, по заряду комплексного иона, по классам соединений. Номенклатура комплексных соединений. Приведите примеры.
Классификация комплексных соединений:
1) по виду координируемых лигандов: +) аквакомплексы, в которых лигандом явл. молекула воды. Например: [Cr(H2O)6]Cl3,
+) аминокомплексы (аммиакаты): лиганды NH3. Например: [Ag(NH3)2]Cl, [Cu(NH3)4](OH)2.
+) ацидокомплексы, в которых лиганды – анионы кислотных остатков. Например: K[Au(CN)2], K2[HgI4].
+)гидроксокомплексы (OH). Пример: Na3[Cr(OH)6]
+) смешанного типа [ Cr(H2O)5Cl]Cl2* H2O
2) по заряду комплексного иона: +) катионные – комплексы имеют катионные к/о. Например: 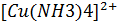 Cl2
Cl2
+) анионные – комплексы имеют анионные к/о. Например: 
+) нейтральные – к/о не имеют заряда. Например: [Fe(CO)5]
3) по классам соединений:
+) кислотные комплексы. Например: H2[SiF6] H[ AuCl4].
+) комплексы основания. Например: [Ag(NH3)2]OH [Ni(NH3)6](OH)2.
+) комплексы соли. Например: K3[Fe(CN)6] [Cu(NH3)2]Cl.
Номенклатура к.с:
Сначала называем анион, затем катион, но с указанием числа и вида лиганд, название читается справа налево, название катионов и анионов пишут раздельно, указывается валентность комплексообразователя.
В случае аниона берется корень латинского названия элемента, к нему добавляется “ат” (станнат, аурат, плюмбат). Например: К3[Al(OH)6] - гексагидроксоалюминат (III) калия; [Cr(NH3)4Cl2]Cl – хлорид дихлоротетрамминхрома (III).
Вопрос 29) Закон Гесса, условия его выполнения. Энтальпии образовании, сгорания, атомизации (определение).
Закон Гесса: Изменение энтальпии (внут. Энергии) химической реакции не зависит от пути процесса, а зависит только от вида и состояния исходных веществ и продуктов реакции.
- Единственным видом работы является работа расширения (отсутствует полезная работа).
- Давление и температура не меняются (р,Т= const) – изобарно-изотермический процесс.
- Объем и температура не меняются (V,T= const) – изохорно-изотермический процесс.
- Химическая реакция должна протекать до конца и необратимо.
- Теплота рассчитывается на 1 моль вещества, т.е. необходимо учитывать стехиометрические коэффициенты в уравнении реакции.
- Тепловые эффекты определяют при нормальных условиях, Т= 25ºС и р = 1 атм, а также используют наиболее устойчивую модификацию.
энтальпия образования  Ноf,298 (или
Ноf,298 (или  Нообр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Нообр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Энтальпия сгорания – Стандартной энтальпией сгорания  Нoсгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии.
Нoсгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии.
Энтальпия атомизации или энергия ионизации – это наименьшая энергия, необходимая для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность.
Вопрос 30) Закон Гесса. Следствия из закона Гесса. При каких условиях выполняется этот закон?
Закон Гесса: вопрос 29
Следствия из закона Гесса:
Следствие 1.  , где ni и nj – числа молей (коэффициенты в уравнении).
, где ni и nj – числа молей (коэффициенты в уравнении).
Следствие 2. 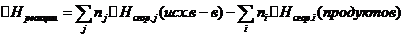 , где ni и nj – числа молей (коэффициенты в уравнении).
, где ni и nj – числа молей (коэффициенты в уравнении).
1. Изменение энтальпии реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов).
2. Изменение энтальпии реакции равно сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции (суммирование проводится с учетом стехиометрических коэффициентов).
Условие выполнения вопрос 29
Вопрос 31) Стандартные термодинамические характеристики. Понятие о стандартном состоянии индивидуальных жидких и кристаллических в-в, газов и растворов. Закон Гесса.
Раздел химии, занимающийся изучением тепловых эффектов процессов – термохимия.
Закон Гесса: вопрос 29
За стандартное состояние раствора принимают идеальный раствор, активность растворенного которого = 1, а энтальпия = энтальпии в реально бесконечно разбавленном растворе.
Фугитивностью (летучестью) называют такую величину, которая связана с другими термодинамическими характеристиками реального газа так же, как с ним связано давление в случае идеального газа.
За стандартное состояние газообр. в-ва принимают состояние гипотетически идеального газа, летучесть которого равна единице, а энтальпии реального газа при той же температуре и давлении, стремящейся к нулю. Т.е. за станд. сост. принимается бесконечно разряженный газ.
Осталась одна проблема – аллотропные модификации. Какую из них брать за стандарт? Берут наиболее устойчивую форму, искл.: фосфор берут белый, а не более устойчивый красный, т.к. он более реактивный; S (к.ромб.), а не S (к. моноклин.); С (к. графит), а не С (к. алмаз). Если все участники процесса наход. в стандарт. состоянии, тогда реакция – стандартная и обозначается верхним правым “ноликом”.
Для жидких и кристаллических индивидуальных веществ в качестве стандартного состояния при каждой температуре принимается их состояние под нормальным давлением.
Вопрос 32) Энтальпия и энергия Гиббса, их физический смысл, связь между ними.
Энтальпия (теплосодержание, тепловая функция Гиббса), потенциал термодинамический, характеризующий состояние термодинамической системы при выборе в качестве основных независимых переменных энтропии S и давления р. Обозначается H
Энергия Гиббса − это термодинамический функция состояния системы. Физический смысл: Энергия Гиббса показывает самопроизвольность в течение химической реакции.
ΔG =  Нт –TΔS
Нт –TΔS
Физический смысл энтальпии: физический смысл энтальпии: ее изменение — это тепло, подведенное к системе в изобарическом процессе (при постоянном давлении).
Проанализируем уравнение  GоТ =
GоТ =  НоТ - Т
НоТ - Т  SоТ. При низких температурах Т
SоТ. При низких температурах Т  SоТ мало. Поэтому знак
SоТ мало. Поэтому знак  GоТ определяется в основном значением
GоТ определяется в основном значением  НоТ (энтальпийный фактор). При высоких температурах Т
НоТ (энтальпийный фактор). При высоких температурах Т  SоТ – большая величина, знак D GоТ определяется и энтропийным фактором. В зависимости от соотношения энтальпийного (
SоТ – большая величина, знак D GоТ определяется и энтропийным фактором. В зависимости от соотношения энтальпийного ( НоТ) и энтропийного (Т
НоТ) и энтропийного (Т  SоТ) факторов существует четыре варианта процессов.
SоТ) факторов существует четыре варианта процессов.
1. Если  НоТ < 0,
НоТ < 0,  SоТ > 0, то
SоТ > 0, то  GоТ < 0 всегда (процесс может протекать самопроизвольно при любой температуре).
GоТ < 0 всегда (процесс может протекать самопроизвольно при любой температуре).
2. Если  НоТ > 0,
НоТ > 0,  SоТ < 0, то
SоТ < 0, то  GоТ > 0 всегда (процесс не протекает ни при какой температуре).
GоТ > 0 всегда (процесс не протекает ни при какой температуре).
3. Если  НоТ < 0,
НоТ < 0,  SоТ < 0, то
SоТ < 0, то  GоТ < 0 при Т <
GоТ < 0 при Т <  Но/
Но/  Sо (процесс идет при низкой температуре за счет энтальпийного фактора).
Sо (процесс идет при низкой температуре за счет энтальпийного фактора).
4. Если  НоТ > 0,
НоТ > 0,  SоТ > 0, то
SоТ > 0, то  GоТ < 0 при Т >
GоТ < 0 при Т >  Но/
Но/  Sо (процесс идет при высокой температуре за счет энтропийного фактора).
Sо (процесс идет при высокой температуре за счет энтропийного фактора).
Вопрос 33) Энергия Гиббса как термодинамическая функция состояния. Определение и свойства. Вычисление стандартной энергии Гиббса процесса по справочным данным. Критерий самопроизвольного протекания реакций.
G – функция состояния системы, называемая энергией Гиббса. Она равна разности энтальпии и произведения энтропии на температуру: G=H – T∙S Абсолютное значение G определить невозможно. ∆G=∆Н – Т∙∆S Рассчитывают ∆G также, как и ∆Н, используя стандартные энергии Гиббса образования веществ. ΔGхим.реакции = ∑niGi(продуктов) − ∑njGj(исх. в-в)
Св-ва ф-ции:
1) однозначная, конечная, непрерывная ф-ция состояния системы;
2) обладает св-вом независимости ΔG от пути перехода от начальных в-в к продуктам.
3) −Aпол ≥ G2 − G1 = ΔG.
Физический смысл энергии Гиббса вытекает из со отношения: -Aпол=U2+pV2-TS2-(U1-pV1-TS1) – энергия Гиббса в равновесном процессе с точностью до знака равна полезной работе, которую может совершить система. В случае протекания неравновесных процессов энергия Гиббса будет (с обратным знаком) равна максимально возможной полезной работе, которую может совершить система..
Критерий самопроизвольного протекания процесса: в системах, находящихся при Р, Т = const, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением энергии Гиббса
( G < 0). При достижении равновесия в системе
G < 0). При достижении равновесия в системе  G = 0.
G = 0.
Вопрос 34) Критерий самопроизвольного протекания реакций, энтальпийный и энтропийный факторы процесса. Какие реакции протекают самопроизвольно в водных растворах?
Критерий самопроизвольного протекания процесса: вопрос 34
ΔG = ΔН – ТΔS. 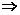 самопроизвольное течение процесса (ΔG< 0) возможно при:
самопроизвольное течение процесса (ΔG< 0) возможно при:
· Если ΔH < 0 и ΔS > 0, то всегда ΔG < 0 и реакция возможна при любой температуре.
· Если ΔH > 0 и ΔS < 0, то всегда ΔG > 0, и реакция с поглощением теплоты и уменьшением энтропии невозможна ни при каких условиях.
· В остальных случаях (ΔH < 0, ΔS < 0 и ΔH > 0, ΔS > 0) знак ΔG зависит от соотношения ΔH и TΔS. Реакция возможна, если она сопровождается уменьшением изобарного потенциала; при комнатной температуре, когда значение T невелико, значение TΔS также невелико, и обычно изменение энтальпии больше TΔS. Поэтому большинство реакций, протекающих при комнатной температуре, экзотермичны. Чем выше температура, тем больше TΔS, и даже эндотермические реакции становятся осуществляемыми.
Чем отрицательней ΔG, тем проще, в более мягких условиях идет процесс.
Энтальпийный и энтропийный факторы процесса:
Если ΔН<0 отражает стремление к объединению частиц в более крупные агрегаты, то ΔS>0 отражает стремление к беспорядочному расположению частиц, к их дезагрегации. Переход системы в состояние с минимальной энергией когда ΔS=0, если же ΔН=0, то система самопроизвольно переходит в наиболее неупорядоченное состояние. Каждая их этих противоположных тенденций, количественно выражаемых ΔН и ΔS зависит от природы в-ва и условий протекания процесса (т-ра, давление, соотношение между реагентами и т.д).
Произведение ТΔS (кДж/моль) явл. энтропийным фактором процесса, ΔН – энтальпийным фактором. В состоянии равновесия: ΔН = ТΔS. Это уравнение явл. условием равновесия, характеризует такое состояние данной системы, когда скорости протекающих в ней противоположных процессов становятся равными. Из этого уравнения 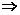
 : расчет изменения энтропии в равновесном процессе возможен из непосредственно измеряемых величин. ΔН фазового перехода можно определить экспериментально с помощью калориметра.
: расчет изменения энтропии в равновесном процессе возможен из непосредственно измеряемых величин. ΔН фазового перехода можно определить экспериментально с помощью калориметра.
Реакции, протекающие самопроизвольно в водных растворах: У которых изменение энергии Гиббса меньше нуля.
Вопрос 35) Химическое равновесие. Истинное (устойчивое) и кажущееся (кинетическое) равновесие, их признаки. Приведите примеры.
Равновесным называют ионное состояние системы, которое не изменяется во времени, и эта неизменность не обусловлена протеканием какого-либо внешнего процесса. Равновесие остается неизменным, пока не изменяются внешние условия. Различают истинное (устойчивое) и кажущееся (кинетическое) равновесие.
Истинное равновесие сохраняется неизменным не вследствие отсутствия процессов, а в силу протекания их одновременно в двух противоположных направлениях с одинаковой скоростью. Истинное равновесие имеет следующие признаки:
1. Если нет внешнего воздействия, то система неизменна во времени.
2. Любое малое внешнее воздействие вызывает изменение в равновесии системы. Если внешнее воздействие снимается, то система возвращается в исходное состояние.
3. Состояние системы будет одинаковым независимо от того, с какой стороны она подходит к равновесию.
Кажущееся равновесие также неизменно во времени при отсутствии внешнего воздействия, однако второй и третий признаки для него не характерны. Примером системы в кажущемся равновесии является пересыщенный раствор: достаточно попадания соринки в такой р-р или встряхивания и начинается выделение из р-ра избыточного растворенного в-ва.
При изменении внешних условий равновесие изменяется сообразно новым условиям, или, как говорят, «смещается».
Вопрос 36) Химическое равновесие. Принцип Ле-Шателье – Брауна и смещение равновесия. Рассмотрите на примере реакции ……
Химическое равновесие вопрос 35
Смещение равновесия подчиняется закономерности, называемой принципом Ле-Шателье: “если на систему, находящуюся в истинном равновесии, воздействовать извне, изменяя какой-либо из параметров, определяющих состояние равновесия, то в системе усилится то направление процесса, который ослабевает эффект воздействия и положение системы сместится в том же напралении”.
Смещение равновесия:
1) Повышение температуры равновесной системы усиливает течение эндотермического процесса, охлаждение – наоборот.
2) изменение давления существенно сказывается лишь на равновесиях газовых систем. Увеличение давления для них ведет к смещению равновесия в сторону меньшего объёма, падение давления – в сторону большего объёма.
3) увеличение концентрации исх. в-в ведет к смещению равновесия вправо (в сторону продуктов).
Вопрос 37) Константа химического равновесия. Соотношение величин Кр и Кс для газовых равновесий. Связь  и константы равновесия.
и константы равновесия.
Количественной характеристикой химического равновесия является константа химического равновесия
2 SO2(г) + O2(г)  2 SO3(г)
2 SO3(г)
В момент равновесия концентрация не меняется, также не меняется парциальное давление газов
Кс = 
Кр = 
Парциальное давление газа – давление, которое бы этот газ производил, занимая весь объем
Связь между Кс и Кр для гомогенных процессов:
P1*V1 = n1RT
P1 = n1*R*T/V = C1*RT
Кр = Кс(RT)^ Δn
Δn – разность коэффициентов при формулах веществ в правой и левой частях в химическом уравнении
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
 GTо = – RTlnK.
GTо = – RTlnK.
Чем меньше энергия гиббса тем выше константа равновесия
K= 1 ΔG=0 химическое равновесие
K<1 ΔG>0 (равновесие сместится влево) K>1 ΔG<0 (равновесие сместится вправо)
Вопрос 38) Равновесие диссоциации ассоциированных (слабых) электролитов на примере.... Степень диссоциации, константа диссоциации. Закон разбавления Оствалда.
Степень диссоциации a - это отношение числа молекул, распавшихся на ионы N¢ к общему числу растворенных молекул N:

Степень диссоциации выражают в процентах или в долях единицы. Если a =0, то диссоциация отсутствует и вещество не является электролитом. В случае если a =1, то электролит полностью распадается на ионы.
К слабым электролитам в водных растворах относят кислоты: угольную, сернистую, сероводородную, серную (по второй ступени), ортофосфорную, все карбоновые к-ты; основания: гидроксиды магния, бериллия, алюминия, аммония, все гидроксиды d-элементов.
Константа диссоциации – константа равновесия в процессе диссоциации одно и то же.
АmBn(k) = mAn+ + nAm-
Кдисс = 
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н+ больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10- 4, а К(HCN) = 4,9·10- 10.
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации  и концентрацией электролита c уравнением Оствальда:
и концентрацией электролита c уравнением Оствальда:
 .
.
Для практических расчетов при условии, что  <<1 используется приближенное уравнение
<<1 используется приближенное уравнение
Кд  .
.
Вопрос 39) Принципы построения шкалы стандартных термодинамических функций образования ионов в водных растворах. Как определить стандартную энтальпию образования …. в водном растворе.
Бесконечно разбавленный раствор – это такой раствор, в котором на каждую молекулу р-ного в-ва приходится на бесконечно большое число молей р-ля. Его характеристики:
1) все электролиты в нём полностью диссоциированы.
2) взаимодействие между ионами полностью отсутствуют.
Любое св-во индивидуального иона, например термодинамическое, не может быть объективно определено. В таких ситуациях прибегают к построению шкалы относительных величин, в которой значение рассматриваемого св-ва для одной из систем постулируется, а значение св-ва других систем отсчитываются от принятого значения. В частности для водных растворов электролитов шкала термодинамических функ. обр. ионов строится на основе следующих допущений:
ΔH0(H+∞ р-р) = 0
S0(H+∞ р-р) = 0
ΔG0 (H+∞ р-р) = 0
На основе этого получаем: ΔНобр0НCl(р-р, ст.с)=ΔНобр0Н+(р-р, ст.с)+ΔНобр0Cl-(р-р, ст.с)= ΔНобр0Cl- (р-р, ст.с)
Нашли ΔНобр0Cl- (р-р, ст.с), затем находим ΔНобр0NaCl (р-р, ст.с), а по ней - ΔНобр0Na+ (р-р, ст.с) и т.д.
Получаем шкалу энтальпий образования ионов.
А как нашли ΔНобр0НCl(р-р, ст.с)? ½ Н2(г) + ½ Cl2(г) + ∞Н2О(ж)=НCl (½ Н2(г) + ½ Cl2(г))= ΔНобр0НCl(г) ----->HCl(г)----(+ ∞Н2О(ж)= ΔНраств0НCl(г))---->HCl Получили: ΔНобр0НCl(р-р, ст.с)= ΔНобр0НCl(г)+ ΔНраств0НCl(г)
А как нашли последнюю величину? ΔНобр0НCl(р-р, HCl*nH2O)= ΔНобр0НCl(г)+ ΔНраств0НCl(г) с образованием р-ра состава HCl*nH2O.
Аналогичным путем были найдены стандартные энергии Гиббса образования ионов и стандартные энтропии ионов. Хотя энтропий в-в могут быть только положительными, энтропии ионов могут быть и отрицательными, поскольку они – относительные величины.
Вопрос 40) Шкалы величин рН и рОН. Вычисление рН растворов неассоциированных электролитов на примерах ….
Равновесие процесса диссоциации воды
Н2О  Н+ + ОН-
Н+ + ОН-
описывается константой Кw, которая носит название “ионное произведение воды”. Ионное произведение воды равно:
Кw = [Н+] [ОН- ].
Для практических целей удобно пользоваться не концентрацией ионов водорода, а её водородным показателем – отрицательным десятичным логарифмом – рН. Величина рН равна:
pH - показатель кислотности или щелочности среды
рН = - lg[H+].
Н+ – активность ионов водорода
1) В нейтральной среде pH = - lg10-7 = 7
2) В кислой среде рН < 7
3) В щелочной среде рН > 7
Однако для практических целей при расчете рН разбавленных растворов обычно используется уравнение
рН + рОН = 14,
где рОН = - lg[ОH-].
4)Тем не менее, в сильнощелочной среде рН может быть немного больше 14, а в очень кислой среде может принимать отрицательные значения.
Вопрос 41) Равновесие диссоциации воды. Ионное произведение воды. Шкалы величин рН и рОН.
Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды распадаться (диссоциировать) на два иона которые и являются проводниками электрического тока в чистой воде:
H2O ↔ H+ + OH-
Диссоциация обратима, то есть ионы H+ и OH- могут снова образовать молекулу воды. В итоге наступает динамическое равновесие, при котором количество распавшихся молекул равно количеству образовавшихся из H+ и OH- ионов.
1) Кд = 
2) Кд H2O может быть найдена из термодинамич. ф-и:
ΔG0дисс = -RT*lnKдисс (используют табличные значения)
3)α<<1 [H2O] в растворе const
Vh2o = 1л mh2o = 1000г
[H2O]равн=1000(г/л)/18(г/моль)=55,6 моль/л. = const
Кд = 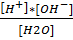
Кдисс*[H2O] = const = [H+]*[OH-] = Kw
[H+]*[OH-] = Kw – ионное произведение воды
Kw = Кдисс*[H2O] = 1.8*10-16 * 55.56 = 10-14
[H+]*[OH-] = Kw = 10-14
Шкала величин рН и рОН вопрос 40
Вопрос 42) Равновесие диссоциации комплексных соединений. Константа устойчивости и константа нестойкости. Реакции образования комплексных соединений. Приведите примеры получения гидроксокомплекса, амминокомплекса и ацидокомплекса.
Реакции образования комплексных соединений: комплексные соединения образуются и существуют в растворах при сравнительно большом избытке лиганд. Обычно его берут в несколько раз больше того количества, которое необходимо в соответствии со стехиометрическим соотношением. В результате подавляется диссоциация комплексного соединения, и оно стабилизируется.
Разная прочность связи во внутренней и внешней сферах комплексного соединения ведет к различию в характере диссоциации этих частей молекулы. По внешней сфере в водных растворах все комплексные соединения являются сильными электролитами, тогда как диссоциация по внутренней сфере происходит в незначительно степени.
K2[Zn(CN)4]  2K+ + [ Zn(CN)4]2-; [Zn(CN)4]2-
2K+ + [ Zn(CN)4]2-; [Zn(CN)4]2-  Zn2+ + 4CN-.
Zn2+ + 4CN-.
Константа равновесия для последнего процесса (диссоциация комплексного иона) называется константой нестойкости: Кравн = Кнест =  .
.
Константа равновесия обратного процесса: Zn2+ + 4CN- = [Zn(CN)4]2- наз. константой устойчивости: Кравн. = Куст. =  .
.
Чем больше Куст. (меньше Кнест.), тем прочнее комплексное соединение, тем слабее оно диссоциирует. Ясно, что произведение Куст. и Кнест. равно единице.
Примеры:
1)Гидроксокомплексы – комплексные соединения, содержащие в качестве лигандов гидроксид-ионы OH-. Гидроксокомплексы образуются в реакциях протолиза из аквакомплексов:
[Al(H2O)6]3+ + H2O  [Al(H2O)5(OH)]2+ + H3O+
[Al(H2O)5(OH)]2+ + H3O+
либо при растворении амфотерных гидроксидов в водных растворах гидроксидов щелочных металлов:
Zn(OH)2 + 2 OH- = [Zn(OH)4]2-
2) Эту группу комплексных соединений можно подразделить на две части: комплексы с кислородсодержащими лигандами и комплексы с бескислородными (преимущественно галогенидными или псевдогалогенидными) лигандами. Например, к ацидокомплексам с кислородсодержащими лигандами относятся дитиосульфатоаргентат(I)-ион, который получается по обменной реакции:
Ag+ + 2 SO3S2- = [Ag(SO3S)2]3-
и гексанитрокобальтат(III)-ион, который осаждается в виде мелких желтых кристаллов калиевой соли при смешивании растворов, содержащих хлорид кобальта(II), нитрит калия и уксусную кислоту:
CoCl2 + 7 KNO2 + 2 CH3COOH =
= K3[Co(NO2)6]¯ + NO + 2 KCl + 2 CH3COOK + H2O
3) Аммиачные комплексы обычно получают при взаимодействии солей или гидроксидов металлов с аммиаком в водных или неводных растворах, либо обработкой тех же солей в кристаллическом состоянии газообразным аммиаком:
AgCl(т) + 2 NH3 . H2O = [Ag(NH3)2]Cl + 2 H2O
Cu(OH)2(т) + 4 NH3 . H2O = [Cu(NH3)4](OH)2 + 4 H2O
NiSO4 + 6 NH3 . H2O = [Ni(NH3)6]SO4 + 6 H2O
CoCl2 + 6 NH3(г) = [Co(NH3)6]Cl2
В тех случаях, когда аммиачный комплекс неустойчив в водном растворе, его можно получить в среде жидкого аммиака:
AlCl3(s) + 6 NH3(ж) = [Al(NH3)6]Cl3(s)
Вопрос 43) Буферные растворы и их св-ва. Расчет рН буферного раствора состава ….
Буферными растворами называют растворы, имеющие постоянное значение рН, не зависящие от разбавления и небольших добавок сильных кислот и щелочей.
1) Они могут быть: смеси слабой кислоты и ее соль
HCN+ KCN
HCOOH + HCOOK
CH3COOH + CH3COONa pH <7
2) Слабое основание и его соль
NH4OH+NH4Cl pH<7
Пример: HCN + KCN
HCN = H+ + CN-
KCN = K+ + CN-
Kдисс HCN = [H+]* [CN-] /[HCN]
[H+] = Кдисс * [HCN]/[CN-]
В присутствии сильного электролита KCN диссоц. HCN подавляется по принципу Ле- Шателье Брауни. Тогд концентрацию HCN можно приравнять к концентрации кислоты исход.
[HCN]равн ̴̴ СHCN исх = Скислоты
[CN-]равн ̴ СKCN исх = Cсоли
[H+] =Кдисс * (Скислоты/С соли)
[OH-] = Кдисс * (С основание/С соли)
Скислоты/С соли = const при разбавлении раствора
H+ + CN- à HCN в кислой среде
OH- + H+ à H2O в щелочной среде
Практически не влияет на рН
Как видно:
1) при разбавлении р-ра водной ведет к одинаковому уменьшению Ск-ты и Ссоли, а отношение Ск-ты/Ссоли не изменится и рН станет прежним.
2) добавим в буферный р-р несколько капель НСl, при этом часть соли превратится в к-ту; в результате Ск-ты немного возрастает, а Ссоли – уменьшится, а отношение Ск-ты/Ссоли и соответственно рН буферного р-ра изменится мало.
3) Подобное произойдет при вливании в буферную смесь нескольких капель р-ра NаОН: Ссоли возрастает, Ск-ты мало уменшится, а отношение Ск-ты/Ссоли и соответственно рН буферного р-ра изменится мало.
Вопрос 44) Равновесие растворения и диссоциации малорастворимого электролита. Произведение растворимости. Связь ПР и растворимости (на примере …..).
АmBn(k)↔ AmBn↔ mA(n+) + nB(m-)- насыщ.р-р
промежуточный раствор
АmBn(k) ↔ mA(n+) + nB(m-)
Kравн = [An+]m * [Bm-]n / [AmBn]
ПР= произведение растворимости (ПР).
Так как [AmBn] = const,то
Kравн *[AmBn] = [An+]m * [Bm-]n = ПР
ПР = [An+]m * [Bm-]n
Таким образом, произведение растворимости (ПР) есть константа равновесия растворения и диссоциации малорастворимого электролита. Оно численно равно произведению концентраций (активностей) ионов в степенях стехиометрических коэффициентов в насыщенном водном растворе данного малорастворимого электролита. Пусть растворимость(кнцентрация насыщенного раствора при данной температуре) электролита равна Р моль/л. Тогда:
ПР= (mp)m (np)n = mm * nn * p m+n
Отсюда находим связь ПР с растворимостью:  .
.
Если ПК > ПР – выпадет осадок, ПК < ПР − осадок растворится, ПК = ПР − установится равновесие. (ПК = [Ktm+]n.[An-]m. ПК – произведение концентраций).
Вопрос 45) Условия выпадения осадка и растворения малорастворимых электролитов. Связь ПР с растворимостью на примере ….
Если ПК > ПР – выпадет осадок, ПК < ПР − осадок растворится, ПК = ПР − установится равновесие. (ПК = [Ktm+]n.[An-]m. ПК – произведение концентраций).
Вопрос 46) Произведение растворимости как константа равновесия растворения и диссоциации малорастворимого соединения. Связь ПР с растворимостью на примере ….
Вопрос 44-45
Вопрос 47) Польный (необратимый) гидролиз. Взаимное усиление гидролиза (совместный гидролиз). Приведите примеры.
Гидролиз – обменная реакция взаимодействия растворенного вещества (например, соли) с водой. Гидролиз происходит в тех случаях, когда ионы соли способны образовывать с Н+ и ОН- ионами воды малодиссоциированные электролиты.
Гидролиз некоторых солей, образованных слабыми основаниями и слабыми кислотами, протекает необратимо.
Необратимо гидролизуется, например, сульфид алюминия:
Al2S3 + 6H2O  2Al(OH)3
2Al(OH)3  + 3H2S
+ 3H2S  .
.
Необратимо протекает гидролиз, если одновременно ввести в раствор соль, образованную тяжелым металлом, и соль, образованную слабой летучей кислотой, например,
2 AI CI3 +3Na2 S + H2O = Al2S3 +6NaCI
CH3COONH4 = CH3COO + NH4
SbCl3 + H2O  SbOCl
SbOCl  + 2HCl.
+ 2HCl.
Взаимное усиление гидролиза. Допустим, что в разных сосудах установились равновесия:
CO32– + H2O  HCO3– + OH–
HCO3– + OH–
Al3+ + H2O  AlOH2+ + H+
AlOH2+ + H+
Обе соли гидролизованы незначительно, но если растворы смешать, то происходит связывание ионов H+ и OH–. В соответствии с принципом Ле – Шателье оба равновесия смещаются вправо, и гидролиз протекает полностью:
2 AlCl3 + 3 Na2CO3 + 3 H2O = 2 Al(OH)3 + 3 CO2 + 6 NaCl
Это называется взаимным усилением гидролиза.
2FeCl3+3Na2CO3+3H2O=2Fe(OH)3+6NaCl+3CO2
2Fe3++3CO32-+3H2O=2Fe(OH)3+3CO2
Al2(SO4)3+3Na2CO3+3H2O=2Al(OH)3+3Na2SO4+3CO2
2Al3++3CO32-+3H2O=2Al(OH)3+3CO2
Cr2(SO4)3+3Na2S+6H2O=2Cr(OH)3+3Na2SO4+3H2S
2Cr3++3S2-+6H2O=2Cr(OH)3+3H2S
2CuCl2 + 2Na2CO3 + H2O → (CuOH)2CO3  + CO2
+ CO2  + 4NaCl
+ 4NaCl
Вопрос 48) Польный (необратимый) гидролиз. Приведите два примера. Совместный гидролиз двух солей с образованием а) гидроксида металла (+3), б) основного карбоната металла (+2).
а) 2NaCl3 (кр)+3Na2CO3 (кр)+3H2O (ж)=2Al(OH)3 (тв) + 3СO2 (г) + 6NaCl(р-р)
б) 2CuCl2 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + CO2↑ + 4NaCl
Вопрос 49) Гидролиз солей одновременно по катиону и аниону (обратимый гидролиз). Расчет константы гидролиза, степени гидролиза и рН растворов таких солей на примере …
Соли, образованные сильным основанием и слабой кислотой, например, CH3COONa, Na2CO3, Na2S, KCN гидролизуются по аниону:
СН3СООNa + НОН  СН3СООН + NaОН (рН > 7).
СН3СООН + NaОН (рН > 7).
AB + H2O = AOH + HB
Кравн = [АОН]* [HB]/ [AB] * [H2O]
[H2O] = const
Kравн[ H2O] = К гидр = const
Kгидр = [AOH] * [HB]/[AB]
Kt+ + A- + H2O = KtOH + HA
Константа гидролиза имеет вид:
 .
.
Пусть общая концентрация соли, гидролизованной одновременно по катиону и аниону, равна с моль/л, степень гидролиза составляет h. Тогда:
 Отсюда:
Отсюда: 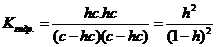 . Значение константы гидролиза не зависит от концентраций солей гидролизованной, или по другому степень гидролиза соли, подвергающейся гидролизу по катиону и аниону одновременно, будет одной и той же при любых концентрациях соли в растворе.
. Значение константы гидролиза не зависит от концентраций солей гидролизованной, или по другому степень гидролиза соли, подвергающейся гидролизу по катиону и аниону одновременно, будет одной и той же при любых концентрациях соли в растворе.
рН растворов: 
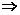
Степень гидролиза называют отношение числа гидрализованных молекул к общему числу растворенных молекул.
Вопрос 50) Гидролиз солей по катиону. Способы подавления гидролиза. Расчет константы гидролиза, степени гидролиза и рН растворов солей, гидролизованных по катиону на примере ….
Соль образована сильной кислотой и слабым основанием (NH4Cl Cu(NO3)2)
NH4Cl= NH4+ + Cl-
NH4+HOH = NH4OH + H+
Кгидр по катиону
A+ + HOH = AOH+ H+ pH<7
Kгидр = [AOH] * [H+] / [A+]
Т.к [AOH] = [H+] * [A+] = Cисх соли
Т.к αг<1 мала
Kг = [H+]2/C исх соли
[H+] = 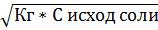
3) Кг = 
Способы подавления гидролиза:
1) охлаждение раствора;
2) добавление кислоты в раствор для подавления гидролиза по катиону, добавление щелочи в раствор для подавления гидролиза по аниону.
Вопрос 51) Гидролиз солей по аниону. Способы подавления гидролиза. Расчет константы гидролиза, степени гидролиза и рН растворов солей, гидролизованных по аниону на примере ….
Соль образована сильным основанием и слабой кислотой (NaCN K2SO3 Na3PO4)
NaCN = Na+ + CN-
CN- + HOH = HCN + OH-
Способы подавления гидролиза:
1) охлаждение раствора;
2) добавление кислоты в раствор для подавления гидролиза по катиону, добавление щелочи в раствор для подавления гидролиза по аниону.
Общий вид гидролиза по аниону:

Тогда константа гидролиза: 
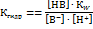
Произведение  дает нам константу ионного произведения воды – КW, а дробь
дает нам константу ионного произведения воды – КW, а дробь  - это константа диссоциации кислоты
- это константа диссоциации кислоты  . Таким образом мы получаем:
. Таким образом мы получаем: 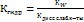
1) Кг = 
Т.к [HB] = [OH-] и [B-] = Ссоли
Т.к αгидр <1 мала
Кг =  [OH+] =
[OH+] = 
Находим [H+] и рН раствора
Степень гидролиза (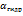 ) равна отношению числа гидролизованных молекул к общему числу растворенных молекул. При гидролизе по аниону
) равна отношению числа гидролизованных молекул к общему числу растворенных молекул. При гидролизе по аниону 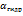 не велика. Чем слабее кислота (или основание), тем больше степень гидролиза.
не велика. Чем слабее кислота (или основание), тем больше степень гидролиза.
 2018-01-21
2018-01-21 6139
6139