Вопрос 1) Св-ва волновой функ. Понятие об уравнении Шредингера. Квантовые числа как характеристики состояния электрона в атоме. Напишите значения квантовых чисел для каждого из d-электронов атома … в основном состоянии.
Законы движения микрочастиц в квантовой механике выражают волновым уравнением Шредингера. Как и законы Ньютона, это уравнение невозможно вывести из каких-либо более фундаментальных положений. Оно было получено Шредингером из определения аналогии между уравнениями механики и оптики на основании двойственной природы микрочастиц.
Уравнение Шредингера явл. дифференциальным уравнением 2 порядка в частных производных. Для стационарного состояния одной частицы массой m оно имеет вид:
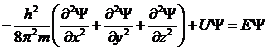 ,
,
где: h – постоянная Планка; Ψ – переменная величина; U – потенциальная энергия частицы; Е – полная энергия частицы; x, y, z – координаты.
Часто уравнение Шредингера записывают в компактной форме: 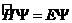 , где
, где 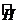 - оператор Гамильтона (гамильтониан), обозначает все те математические действия, которые производят в левой части над величиной Ψ.
- оператор Гамильтона (гамильтониан), обозначает все те математические действия, которые производят в левой части над величиной Ψ.
Переменная Ψ наз. волновой функцией.(Характеризует состояние (положение) е в атоме) Её Ψ2 имеет определенный физ. смысл: Ψ2.dv = вероятности нахождения е в элементарном объёма. Величина Ψ2 наз. плотностью вероятности, или электронной вероятности.
Ψ должна быть конечной, непрерывной, однозначной, и обращаться в нуль в тех местах пространства, где не т частицы, те на большом расстоянии от ядра
Ψ – функция зависит не только от трех координат, но и от трех целочисленных параметров, названных квантовыми числами. Их обозначение n, l и ml. Эти 3 величины могут получать только целочисленные значения.
n – главное квантовое число. Оно характеризует энергию е в атоме, номер электронного слоя, среднее расстояние от ядра, общее число узловых поверхностей.Оно принимает значения от +1→+∞. Кроме цифрового обозначения n используется и буквенная индексация: n =1↔K, n =2↔L, n =3↔M, n =4↔N,
l – орбитальное (побочное) кв. число, характеризует энергию электрона внутри слоя и определяет форму электронного облака, орбитальный момент количественного движения е. Оно принимает значения от 0→+(n−1). На практике l чаще обозначается буквами: l =0↔s, l =1↔p, l =2↔d, l =3↔f, l =4↔g, …, l =n−1.
ml − магнитное кв. число, характеризует расположение или ориентацию орбитали в пространстве, величину проекции орбитального момента, количество движения на ось Z. При данном значении l, ml принимает значения: 0, ±1→± l. Общее число значений ml: (2l+1).
В соответствии с тем, что е вращается не только вокруг ядра, но и вокруг оси, фактически появляется 4 квантовое число – магнитное квантовое число m s. Оно принимает два значения: 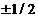 . Показывает, что е имеет собственный магнитный момент количества движения вращения
. Показывает, что е имеет собственный магнитный момент количества движения вращения 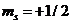 ↑,
↑, 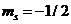 ↓.
↓.
Принцип Паули: в атоме не может быть двух электронов с одинаковым набором 4-х квантовых чисел.
Правило Хунда: суммарный спин электронов оболочки должен быть максимальным.
Вопрос 2) Св-ва волновой функ. Понятие об уравнении Шредингера. Что такое узловые поверхности? Охарактеризуйте квантовыми числами следующее состояние электронов (в основном состоянии): ….
Вопрос
Узловой поверхностей орбитали наз. геометрическое место точек, где нет е, волновая функ. 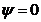 (
(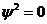 ). Узловые поверхности могут быть сферическими, плоскими и коническими. По определению каждая орбиталь имеет сферическую узловую поверхность с бесконечным радиусом. Главное кв. число равно общему числу узловых поверхностей данной орбитали.
). Узловые поверхности могут быть сферическими, плоскими и коническими. По определению каждая орбиталь имеет сферическую узловую поверхность с бесконечным радиусом. Главное кв. число равно общему числу узловых поверхностей данной орбитали.
Вопрос 3) Дайте опр. следующим понятиям: электронный слой, электронная оболочка, электронное облако, электронная орбиталь, узловая поверхность. Сколько максимально электронов может быть в …-слое, на … - оболочке?
Электронный слой (уровень) – совокупность электронов с одним и тем же значением главного кв. числа n. Максимальное число е в слое n: 2n2.
n=1: 1-ый слой или К-слой; n=2: 2-ой слой или L-слой; n =3: 3-ий слой или M-слой; и т.д
Электронная оболочка – совокупность эл-нов с одним и тем же значением побочного кв. числа l. Мак. число е в оболочке l: 2(2l+1). (2- число значений спинов).
l = 0 s-оболочка; l = 1 p-оболочка; l = 2 d-оболочка; l = 3 f-оболочка; l = 4 g-оболочка.
Электронная орбиталь – совокупность эл-нов с одним и тем же значением магнитного кв. числа ml.При данном значении l, магнитное кв. число принимает значения: 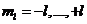 . Общее число значений составляет (2l+1).
. Общее число значений составляет (2l+1).
Электронное облако — это наглядная модель, отражающая распределение функции плотности вероятности обнаружения электрона в атоме или молекуле в зависимости от энергии электрона.
Узловой поверхностей орбитали наз. геометрическое место течек, где волновая функ. 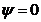 (
(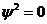 ). Узловые поверхности могут быть сферическими, плоскими и коническими. По определению каждая орбиталь имеет сферическую узловую поверхность с бесконечным радиусом. Главное кв. число равно общему числу узловых поверхностей данной орбитали.
). Узловые поверхности могут быть сферическими, плоскими и коническими. По определению каждая орбиталь имеет сферическую узловую поверхность с бесконечным радиусом. Главное кв. число равно общему числу узловых поверхностей данной орбитали.
Вопрос 4) Принцип Паули и правило Хунда. Сколько максимально электронов может быть в электронном слое, электронной оболочке, на орбитали? Какую форму имеют s-, p-, d- орбитали?
Принцип Паули: в атоме не может быть двух электронов с одинаковым значением всех 4-х квантовых чисел.
Правило Хунда: заполнение оболочек происходит таким образом, чтобы суммарный спин электронов оболочки должен быть макссиммальным.
Максимальное число е в оболочке l: 2(2l+1).
Максимальное число е в слое n: 2n2.
Максимальное число на орбитали: 2е.
Вопрос 5) Энергия электрона в многоэлектронном атоме. Энергический ряд атомных орбиталей. Напишите электронные формулы атомов …, и иона …. Какие степени окисления может иметь … в соединениях?
Энергия электрона в атоме водорода (теория Бора) определяется единственным (главным) квантовым числом, а в многоэлектронном атоме – главным и орбитальным квантовыми числами. В целом энергия электрона возрастает по мере роста суммы названных квантовых чисел при доминирующем значении квантового числа. При одинаковой сумме энергия состояния с меньшим значением гл. кв. числа ниже. В соответствии с этими правилами энергетический ряд атомных орбиталей выглядит следующим образом:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p и т.д.
Вопрос 6) Современная формулировка периодического закона. Энергия ионизации и сродство к электрону, закономерности в их изменении по периодам и группам периодической системы.
Свойства химических элементов, а также формы и свойства образуемых ими соединений, находятся в периодической зависимости от величины заряда ядер их атомов.
Энергия ионизации - представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность.
В целом в периоде в соответствии с тенденцией изменения атомных радиусов и увеличением притяжения электронов к ядру должна возрастать. Однако этот рост неравномерен.
Энергия, выделяющаяся при добавлении электрона к нейтральному атому, переходящему при этом в отрицательный однозарядный ион, наз. сродством к электрону. Сродство к двум или более электронам отрицательно. Наиболее часто энергию ионизации и сродство к электрону выражают в электроновольтах (эВ). 1 эВ = 1,60.10-19 Дж = 1,6.10-12 эрг.
Факторы, определяющие энергию ионизации (энтальпию ионизации):
1) эффект экранирования заряда ядра глубинными оболочками и слоями – уменьшение энергии ионизации атомов в подгруппе.
2) эффект проникновения внешних электронов к ядру. Согласно квантовой механике вероятность нахождения электрона в других слоях кроме «своего» не равна нулю. Этот эффект ведет к упрочнению связи электрона с ядром, т.е. к росту энергии ионизации, (самые проникающие s-электроны, менее – p и еще менее –d).
3) отталкивание электронов одного слоя, особенно находящихся на одной орбитали – уменьшение энергии ионизации.
Энергия ионизации, потенциал ионизации обратно пропорциональны радиусу элемента/ атома
Вопрос 7) Атомные и ионные радиусы, как их определяют? Как изменяются радиусы в радах: …
Поскольку квантовая механика запрещает точное определение координат частицы, понятия «радиус атома», «радиус иона» условны. Атомные радиусы подразделяют на радиусы атомов металлов, ковалентные радиусы атомов металлов и радиусы атомов благородных газов. Их определяют как половину расстояния между слоями атомов в кристаллая соответствующих простых в-в. рентгенографическим или нейтронографичским методами.
В общем случае радиус атома зависит не только от природы атомов, но и от характера химической связи между ними, агрегатного состояния, температуры и ряда других факторов. Это обстоятельство лишний раз указывает на относительность понятия «радиус атома». Атомы не являются несжижаемыми, неподвижно застывшими шариками, они всегда принимают участие во вращательном и колебательном движении.
Радиусы атомов благородных газов значительно больше радиусов атомов неметаллов соответствующих периодов, поскольку в кристаллах благородных газов межатомное взаимодействие очень слабое.
Современная шкала ионных радиусов основана на допущении, что границей между ионами является точка минимума электронной плотности на линии, соединяющей центры ионов.
Вопрос 8) Атомные и ионные радиусы, как их определяют? Основные закономерности их изменения по периодам и группам периодической системы.
Вопрос 7
Периодический закон ведёт к след. закономерностям в изменении атомных и ионных радиусов:
1) в периодах слева направо в целом радиус атома уменьшается
2) в подгруппах сверху вниз происходит рост радиуса атома: 3) радиус катиона меньше радиуса атома и уменьшается с ростом заряда катиона.
4) радиус аниона больше радиуса атома.
5) в периодах радиусы ионов d-элементов одинакового заряда плавно уменьшаются, это так называемое d-сжатие.
6) аналогичное явление отмечается и для f-элементов.
7) Радиусы однотипных ионов (имеющих сходную электронную «макушку») в подгруппах плавно возрастают.
8) Если различные ионы имеют одинаковое число электронов (изоэлектронные), то размер таких ионов будет определяться зарядом ядра иона. Наименьшим будет ион с большим зарядом ядра. Радиус изоэлектронных ионов уменьшается с ростом заряда иона. Радиус хрома одинаковые и атомов и ионов.
Вопрос 9) Относительная сила кислот и оснований (схема Косселя) на примерах ….
Сила кислородных кислот будет возрастать с увеличением степени окисления атома элемента и уменьшается радиуса его иона. У оснований наоборот.
Сила бескислородных кислот возрастает с уменьшением степени окисления атома элемента и увеличением радиуса его иона. Сила бескислородных кислот в растворе будет возрастать в подгруппе, т.к при одинаковой степени окисления атома элемента увеличивается радиус его иона.
Более сильным электролитам из двух считается тот, у которого при одинаковой молярной концентрации больше степень диссоциации.
Вопрос 10) Основные положения метода валентных связей при описании химической связи. Валентные возможности атомов ….
Основные положения метода валентных связей:
1) Образуют химическую связь два электрона с антипараллельными спинами; происходит перекрывание электронных орбиталей и повышение электр. плотности между ядрами;
2) связь локализована в направлении максимального перекрывания Ψ-функций электронов; по линии соединяющей центры ядер
3) чем сильнее перекрывание, тем прочнее связь;
4) валентность атома численно равна количеству неспаренных электронов на внешнем слое в основном состоянии или могут быть в возбужденном состоянии + число неподеленных электронных пар внешнего слоя
Вопрос 11) Донорно – акцепторный механизм образования ковалентной связи на примерах молекул …, и ионов ….
Образование химической связи возможно и за счет пары электронов, принадлежавших до образования связи одному из атомов. Такую связь называют донорно-акцепторной.
Первоначало атом А имеет пару е, а атом В – свободную орбиталь. Атом А отдаёт один е атому В, первый становится катионом с неспаренным е, а второй – анионом с неспареннм е. Далее эти частицы традиционным способом образуют полярную ковалентную связь.
Вопрос 12) Гибридизация атомных орбиталей при описании химической связи. Варианты гибридизации с участием s-, p- и d- орбиталей. Какие из приведенных молекул линейные: …?
Несколько разных, но не сильно отличающихся по энергии орбиталей заменяются таким же числом одинаковых по энергии, а значит и симметрично расположенных в пространстве орбиталей.
Как видно, гибридная орбиталь более вытянута в сторону связи, следовательно перекрывание будет более сильным, а связь более прочной по сравнению со связью, образуемой негибридной орбиталью.
sp – линейная 1800.
sp2 – правильный треугольник 1200.
sp3 – тетраэдр 109028’.
dsp2 – расположение партнеров по вершинам квадрата относительно центрального атома (характерно для комплексных соединений).
dsp3 – прав. тригональная пирамида.
d2sp3 – октаэдр.
В гибридную комбинацию практически всегда включают свободные (неподеленные) электронные пары, имеющиеся у атома, в отношении связей которого применяются гибридные представления. Таким образом, для нахождения типа гибридизации орбиталей атома следует просуммировать число его партнеров по химической связи и число свободных электронных пар (у воды 2+2 и sp3 – уголковая, угол 109028’).
Вопрос 13) Гибридизация атомных орбиталей при описании химической связи. Варианты гибридизации с участием s-, p- и d- орбиталей. Какие из преведенных молекул плоские: …? (вопрос 12)
Вопрос 14) Гибридизация атомных орбиталей при описании химической связи. Изобратите схемы перекрывания атомных орбиталей при образования связей в молекулах: …
Вопрос 15) Образование кратных связей. δ- и π- связи, их особенности. Изобратите схемы перекрывания атомных орбиталей при образования связей в молекулах: …
По характеру перекрывания орбиталей обычно выделяют σ - и π - связи. Связи, образованные электронными орбиталями, имеющими максимум зоны перекрывания на линии, соединяющей ядра, называются σ - связями.
Пи - связь - связь, имеющая максимальное перекрывание орбитали по обе стороны от линии, соединяющей ядра.
В подавляющем большинстве случаев π - связи менее прочные, чем σ - связи. В кратной связи только одна связь σ - типа, все остальные (одна или две) относятся к π - связям.
Вопрос 16) Процедура наложения валентных схем в методе валентных связей для объяснения дробной кратности связи на примерах молекул … и иона …
Классический метод ВС не способен объяснить дробный характер связи, а многие частицы характеризуются именно такими связями. Был предложен оригинальный подход. Реальное распределение связей в частице представляется результатом наложения валентных схем с различной кратностью связей. Например, полуторная связь является наложением двух схем, где 1 одинарная связь, а во 2 двойная связь.
Вопрос 17) Модель отталкивания локализованных электронных пар (метод Гиллеспи). Основные положения на примере молекул ….
Простым и удобным методом предсказания геометрии молекул является модель отталкивания локализованных электронных пар или метод Гиллеспи, имеющий в своей основе метод ВС.
Основные положения:
1) Ядро центрального самого ионного атома в молекуле вместе с внутренними оболочками образует шарообразную поверхность. В центре находится центральный многовалентный атом.
2) Все валентные электронные пары в молекуле (поделенные и неподеленные) обозначаются точками и располагаются на шарообразной поверхности в пространстве на максимальном удалении друг от друга
3) В зависимости от числа локализованных электронных пар они располагаются в пространстве след образом:
2 – линейная конфигурация
3 – правильный треугольник
4 – тетраэдр
5 – правильная тригональная бипирамида
6 – октаэдр
7 – октаэдр с искажением или правильная пентагональная пирамида.
3) Во втором приближении метода Гиллеспи учитываются факторы, искажающие исходную правильную конфигурацию:
Наличие неподеленных электронных пар
Кратные связи
Разные заместители у центрального атома
Процедура работы: центральный атом – А (самый многовалентный атом), связанный с ним другой атом – В, неподеленная электронная пара – Е; общее число партнеров центрального тома по хим. связи – n; а число неподеленных эл. пар у него – m. ABnEm.
 2018-01-21
2018-01-21 1192
1192







