Процедура определения старшинства заместителей при центре хиральности усложняется, если заместителями являются не единичные атомы, а группы атомов. На основании такой видоизмененной процедуры построены большие ряды старшинства, вкоторых каждому заместителю присвоен определенный номер. Чем больше этот номер, тем старше заместитель (см., например: Химическая энциклопедия, 1992, т.3, с.289). Однако, эти ряды не универсальны. Позтому лучше познакомиться с тем, как определяется старшинство сложных заместителей. Сделаем это на нескольких примерах.
Пример I.
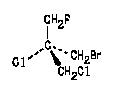
В этом соединении асимметрический атом связан с атомом хлора и тремя атомами углерода. Поскольку хлор имеет больший атомный номер, он является самым старшим (а). Для того, чтобы расположить по старшинству остальные три заместителя, поступают следующим образом.
Выделяют "слои" атомов, постепенно удаляющиеся от асимметрического атома:

Так как атомы первого слоя одинаковы, переходят ко второму слою ирассматривают тройки атомов (можно использовать такую запись троек атомов второго слоя, связанных с атомами углерода первого слоя: С(F,H,H), C(Cl,H,H), C(Br,H,H). Выделяют старший атом в каждой тройке(эти атомы подчеркнуты) и сравнивают их старшинство: F < CI < Вr
|
|
|
В таком же порядке изменяется и старшинство заместителей, в состав которых входят данные атомы:
| СН2F < | СН2CI < | СН2Br |
| (d) | (с) | (b) |
Теперь можно обозначить конфигурацию соединения:

Пример 2.
Этот пример иллюстрирует определение порядка старшинства в случае двух алициклических заместителей.

Очевидно, что в данном соединении самым старшим заместителелем является хлор (а), самым младшим - водород (d). Рассмотрим циклопропильную и циклобутильную группы, выделив слои атомов:

В I и П слоях у обоих заместителей набор атомов одинаков. В третьем же слое циклобутильная группа имеет атом С, а циклопропильная - только атомы Н. Следовательно, циклобутильный заместитель старше:

Соединению следует приписать R -конфигурацию

Аналогично поступают и в случае алкильных заместителей:
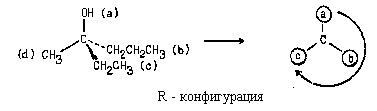
Пример 3:

Рассмотрим определение порядка старшинства заместителей при асимметрическом атоме, отмеченном звездочкой. Ясно, что самым старшим заместителем является фтор (а), самым младшим - группа CH3 (d). Для выбора между двумя оставшимися заместителями обратимся ко второму слою атомов:

В двух тройках второго слоя старшие атомы - Cl- одинаковые. Поэтому сравниваем следующие по старшинству атомы в тройках того же слоя (подчеркнуты дважды): F старше С. Следовательно, и весь правый заместитель старше левого:

Рассматриваемый центр хиральности имеет S-конфигурацию:

В данном примере мы сделали выбор старшинства двух сложных заместителей при paccмотрении второго слоя атомов. Если бы мы рассмотрели третий слой, то преимущество получил быдругой заместитель (Br старше С). Однако, мы не достигаем этого пункта в наших сравнениях, так как можем сделать выбор уже на основании первого встретившегося нам различия.
|
|
|
Пример 4.
Этот пример иллюстрирует определение порядка старшинства в том случае, когда в заместителе имеются атомы, связанные кратными связями (двойными или тройными).
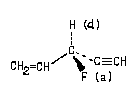
Здесь самый старший заместитель при асимметрическом атоме - F(а), самый младший - Н (d). Для того, чтобы осуществить выбор винильным и этинильным заместителями, кратные связи "раскроем" так, чтобы все атомы были связаны только простыми связями. На концах этих "раскрытых" связей поместим дубликаты тех атомов, к которым данная связь была направлена до "раскрытия". В приведенной ниже схеме дубликаты атомов выделены кружками:

Теперь сравним эти два заместителя аналогично тому, как мы это делали в предыдущих примерах:

Различие во втором слое позволяет заключить, что этинильный заместитель старше винильного;

Соединение имеет R-конфигурацию.
Здесьнеобходимо сделать два замечания.
I) Дублируют сами себя только атомы, связанные кратной связью. Другие атомы,связанные с дублируемыми атомами простыми связями (в приведенном примере - атом водорода) не дублируются.
2) Если в процедуре сравнения участвуют атомы, входящие в состав ароматического кольца, то такое кольцо рассматривается как структура Кекуле и "раскрытие" двойных связей в кольце производят в соответствии с описанной выше процедурой. При этом несущественно, какую из структур Кекуле использовать, поскольку "раскрытие" связей во всех слоях дает одинаковый результат:

Обратите внимание на то, что дубликаты атомов представляют собой "тупиковые" ветви, то есть не находят продолжения в последующих слоях атомов. К дубликатам атомов можно присоединить так называемые "фантомные" атомы (см. раздел X), Однако, существа дела это не изменяет.
В заключение следует отметить, что R,S- номенклатура - это лишь один из возможных способов обозначения абсолютной конфигурации, то есть реального пространственного строения молекул.
V.Оптическая активность. Рацематы.
Структурные изомеры обладают различными физическими и химическими свойствами. Энантиомеры же совершенно одинаковы в "ахиральиых" условиях. Так, у них одинаковы температуры плавления и кипения, растворимость, плотность, реакционная способность по отношению к ахиральным реагентам. Различие между ними проявляется только в хиральных условиях. Например, энантиомеры ведут себя по-разному в ферментативных реакциях, поскольку все ферменты хиральны. Отличаются они также по отношению к плоскополяризованному свету.
Вещество, состоящее из хиральных молекул одного вида (например, из молекул с R-конфигурацией хирального центра), способно вызвать поворот плоскости колебаний поляризованного света. О таком веществе говорят, что оно обладает оптической активностью. Если при прохождении света через вещество плоскость колебаний поворачивается по часовойстрелке (наблюдатель смотрит навстречу лучу), вещество, называют правовращающим, и углу поворота придается положительное значение (+). Если поворот происходит против часовей стрелки, то вещество называют левовращающим, и угол будет отрицательным (-). Хиральные молекулы с противоположной абсолютной конфигурацией, то есть энантиомеры, вращают упомянутую плоскость в противоположных направлениях на один и тот же угол.
Объяснение причин оптической активности веществ, состоящих из хиральных молекул, довольно сложно. Были предложены разные модели, объясняющие это явление. Наиболее продуктивной из них оказалась- так называемая спиральная модель оптической активности, в которой хиральная молекула аппроксимируется спирально закрученным металлическим проводником. Такой подход имеет вполне определенные основания. Так, были проведены эксперименты, в которых на пути плоскополяризованного микроволнового излучения помещались медные спиральки. При этом наблюдалось вращение плоскости поляризации микроволнового излучения, причем левые и правые спиральки вращали эту плоскость а разные стороны. Спиральная модель оптической активности позволяет объяснить, почему, несмотря на хаотическую ориентацию молекул оптически активного вещества относительно падающего луча, совокупность этих молекул поворачивает плоскость поляризации в одну, вполне определенную сторону. Интересующимся данным вопросом можно порекомендовать следующую литературу: У.Козман, Введение в квантовую химию, М., Мир, 1960, с.468-482 или адаптированный для химика-органика вариант: Дж.Брюстер, "Cпиральная модель оптической активности (в сборнике "Избранные проблемы стереохимии", М., Мир, 1970, С; 217-283).
|
|
|
Угол вращения плоскости колебаний поляризованного света для оптически активных веществ измеряют в специальных приборах - поляриметрах. В поляриметре на пути луча плоскополяризованного света помещается кювета с раствором оптически активного вещества. Наблюдаемое при этом оптическое вращение зависит от ряда параметров: температуры, концентрации вещества и др. В качестве характеристики оптически активного вещества используют удельное вращение, которое вычисляется по формуле:

где t-температура (°С), D- символизирует используемую обычно для измерений длину волны света 589 нм (D- линия натрия), - наблюдаемое вращение (в градусах), l- длина кюветы (толщина слоя раствора) в дм, с - концентрация раствора (в г на 100 мл раствора).
В качестве примера ниже приведены данные для энантиомерных молочных кислот:

Если раствор содержит равные количества R- и S-изомеров данного вещества, то такой раствор не обладает оптической активностью, поскольку энантиомеры вращают плоскость поляризации света на одинаковый угол, но в противоположных направлениях. Твёрдое вещество, полученное при кристаллизации из такого раствора, также будет содержать равные количества двух энантиомеров, поскольку они обладают одинаковой растворимостью в данном растворителе. В отличие от индивидуальных энантиомеров, в таких случаях говорят о рацематах (строго говоря, рацематом называется гомогенная фаза (твердая, жидкая или газообразная, содержащая равные количества энантиомеров). Рацематы оптически неактивны.
|
|
|
Связан ли как-то знак оптического вращения с обозначением конфигурации данного энантиомера как R или S? Иногда такие корреляции удается провести, опираясь на упомянутую выше спиральную модель оптической активности. Однако, в общей случае на поставленный вопрос следует дать отрицательный ответ:
| Знак оптического вращения данного энантиомера не связан с обозначением его конфигурации как R или S. |
Ниже приведены примеры, иллюстрирующие это положение.

Такая ситуация становится понятной, если принять во внимание, что направление, в которой данная молекула вращает плоскость поляризации света определяется природой молекулы, поляризуемостью ее фрагментов. Приписание же R- или S-конфигурации центру хиральности - в значительной мере условность. При этом мы следуем формальному алгоритму, особенно в тех случаях, когда различие между заместителями проявляется в отдаленных от центра хиральности "слоях" атомов.
У этого вопроса есть и другая сторона. Дело в том, что оптическое вращение находится в сложной зависимости от ряда параметров, в частности, от температуры и природы растворителя, в котором производятся измерения. Так, диэтиловый эфир правовращающей винной кислоты представляет собой жидкость, имеющую удельное вращение [  ]D20 = +7,4o.Раствор этого вещества, в этилацетате также вращает вправо, [
]D20 = +7,4o.Раствор этого вещества, в этилацетате также вращает вправо, [  ]D20 = +10,0°. Однако, раствор вхлороформе оказывается уже левовращаюшим, [
]D20 = +10,0°. Однако, раствор вхлороформе оказывается уже левовращаюшим, [  ]D20 = -3,19o. С ростом температуры левое вращение раствора в хлороформе уменьшается, при 3б° проходит через нуль и затем становится правым, [
]D20 = -3,19o. С ростом температуры левое вращение раствора в хлороформе уменьшается, при 3б° проходит через нуль и затем становится правым, [  ]D50 = +1,26. Один и тот же энантиомер яблочной кислоты меняет знак вращения в водном растворе в зависимости от концентрации: [
]D50 = +1,26. Один и тот же энантиомер яблочной кислоты меняет знак вращения в водном растворе в зависимости от концентрации: [  ]D23 = + 2,72°, при концентрации 64% и [
]D23 = + 2,72°, при концентрации 64% и [  ]D23 = -0,90°, при концентрации 21%(имеются в виду [
]D23 = -0,90°, при концентрации 21%(имеются в виду [  ]D23, рассчитанные из величин
]D23, рассчитанные из величин  для той или иной концентрации (примеры взяты из монографии: В.И.Потапов, Стереохимия, М,, 1989.). Поэтому обычно, помимо [
для той или иной концентрации (примеры взяты из монографии: В.И.Потапов, Стереохимия, М,, 1989.). Поэтому обычно, помимо [  ]Dtуказывают также концентрацию, при которой производилось измерение, и растворитель.
]Dtуказывают также концентрацию, при которой производилось измерение, и растворитель.
Если в названии хотят передать не только абсолютную конфигурацию молекул оптически активного соединения, но и знак вращения плоскости поляризации света, то перед названием помещают знак (+) для правовращающего соединения и знак (-) - для левовращающего. Так, названия приведенных выше в качестве примера соединений (18)-(21) будут такими
| (-)-S-аланин | (+)-метиловый эфир (S)-аланина |
| (18) | (19) |
| (-)-(R)-адреналин | (+)-(R)-глицериновый альдегид |
| (20) | (21) |
Если же говорят орацемате, то перед названием помещают знак (±), например: (±)-аланин.
VI.Молекулы с двумя асимметрическими атомами.
Диастереомеры.
Если в молекуле есть несколько асимметрических атомов, появляются особенности в построении проекций Фишера, а также новый тип взаимоотношений между стереоизомерами, которого нет в случае молекул с одним асимметрическим атомом.
Рассмотрим принцип построения проекций Фишера для одного из стереоизомеров 2-бром-З-хлорбутана.

Запись в скобках (2S,3S) означает, что атом углерода с номером 2 имеет S-конфигурацию. То же относится к атому углерода с номером 3. Нумерация атомов в молекуле производится в соответствии с правилами ИЮПАК для наименования органических соединений.
Асимметрическими атомами в этой молекуле являются атомы углерода С(2) и С(3). Поскольку данная молекула может существовать в различных конформациях относительно центральной связи С-С, необходимо условиться, для какой конформации мы будем строить проекцию Фишера. Следует запомнить, что проекция Фишера строится только для заслоненной конформации, причем такой, в которой атомы С, составляющие углеродную цепочку молекулы, располагаются в одной плоскости.
Переведем изображенную выше молекулу в заслоненную конформацию и развернем ее таким образом, чтобы углеродная цепочка была расположена вертикально. Полученная при этом клиновидная проекция соответствует такому расположению молекулы, при котором все связи С-С находятся в плоскости чертежа:

Повернем всю молекулу на 90°относительно центральной связи С-С, не изменяя ее конформацию так, чтобы CН3-группы ушли под плоскость чертежа. При этом атомы Br, CI и связанные с С(2) и С(3) атомы водорода окажутся над плоскостью чертежа. Спроектируем ориентированную таким образом молекулу на плоскость чертежа (атомы, находящиеся под плоскостью проектируем вверх; атомы, расположенные над плоскостью - вниз) аналогично тому, как мы делали это в случае молекулы с одним асимметрическим атомом:

В полученной таким образом проекции подразумевается, что лишь центральная связь С-С лежит в плоскости чертежа. Связи С(2)-CН3 и C(3)-CН3 направлены от нас. Связи атомов С(2) и С(3) с атомами Н, Вr и CI направлены к нам. Атомы С(2) и С(3) подразумеваются в точках пересечения вертикальной и горизонтальных линий. Естественно, что при пользовании полученной проекцией необходимо соблюдать изложенные выше правила (см.правила).
Для молекул с несколькими асимметрическими атомами число стереоизомеров равно в общем случае 2n, где n - число асимметрических атомов. Следовательно, для 2-бром-З-хлорбутана должны существовать 22 - 4 стереоизомера. Изобразим их с помощью проекций Фишера.

Эти стереоизомеры можно подразделить на две группы: А и Б. Изомеры А (I и П) связаны операцией отражения в зеркальной плоскости - это энантиомеры (антиподы). То же самое относится к изомерам группы Б: Ш и IV - также энантиомеры.
Если же мы сравним любой из стереоизомеров группы А с любым стереоизомером группы Б, то обнаружим, что они не являются зеркальными антиподами.
| Пространственные изомеры, не являющиеся энантиомерами по отношению друг к другу, называются ДИАСТЕРЕОМЕРАМИ |
Таким образом, I и Ш - диастереомеры. Аналогично, диастереомерами являются по отношению друг к другу I и IV, II и III, II и IV.


Могут реализоваться случаи, когда число изомеров меньше предсказываемого формулой 2n. Такие случаи встречаются, когда окружение центров хиральности создается одним и тем же набором атомов (или групп атомов), например, в молекулах 2,3-дибромбутанов:

(*Молекулы V и VI хиральны, поскольку в них отсутствуют элементы симметрии группы Sn. Однако, и в V и в VI есть простая поворотная ось симметрии С2, проходящая через середину центральной связи С -С, перпендикулярная плоскости чертежа. На этом примере видно, что хиральные молекулы не обязательно асимметричны).
Нетрудно видеть, что проекции VII и VII' изображают одно и то же соединение: эти проекции полностью совмещаются друг с другом при повороте на 180° в плоскости чертежа. В молекуле VII легко обнаруживается плоскость симметрии, перпендикулярная центральной С-С-связи и проходящая через ее середину. В данном случае в молекуле есть асимметрические атомы, но в целом молекула ахиральна. Соединения, состоящие из таких молекул, называются мезо-формами. Мезо-форма не способна вращать плоскость поляризации света, то есть она оптически неактивна.
Согласно определению, любой из энантиомеров (V) и (VI) и мезо-форма являются по отношению друг и другу диастереомерами.
Как известно, физические свойства энантиомеров идентичны (за исключением отношения к плоскополяризованному свету). Иначе обстоит делос диастереомерами, поскольку они не являются зеркальными антиподами. Их физические свойства отличаются так же, как свойства структурных изомеров. Ниже это показано на примере винных кислот.
| Винные кислоты | |||
 |  | ||
[  ]D20 ]D20 | +11,58о | -11,58о | 0о |
| т.пл.,°С | |||
| растворимость в 100 г воды (18°) | 139 г | 139 г | 125 Г |
VII Относительная конфигурация. Эритро-трео-обозначения.
В отличие от понятия "абсолютная конфигурация", термин "относительная конфигурация" используется, по крайней мере, в двух аспектах. Так, под относительной конфигурацией понимается структура соединения, определенная по отношению к некоторой "ключевой" модели путем химических переходов. Таким путем в свое время была определена конфигурация асимметрических атомов в молекулах углеводов по отношению к глицериновому альдегиду. При этом рассуждали примерно так: "Если (+)-глицериновый альдегид имеет изображенную ниже конфигурацию, то связанный с ним химическими превращениями углевод имеет такую-то конфигурацию асимметрических атомов".

Позже, когда был разработан рентгенографический метод определения абсолютной конфигурации, было показано, что в данном случае догадка о том, что (+)-глицериновый альдегид имеет изображенную конфигурацию, верна. Следовательно, верно и отнесение конфигураций асимметрических атомов в углеводах.
Термин "относительная конфигурация" имеет и другое значение. Его используют при сравнении диастереомеров по различиям во взаимном расположении выбранных групп внутри каждого диастереомера. Именно в этом плане об относительной конфигурации говорится в номенклатурных правилах ИЮПАК по химии. Рассмотрим два способа обозначения относительной конфигурации (взаимного расположения групп внутри молекулы) диастереомеров с асимметрическими атомами [существуют диастереомеры без асимметрических атомов, например, цис-и транс-алкены (см. ниже)] на примере стереоизомеров 2-бром-3-хлорбутана (1)-(1V).
В первом варианте используются конфигурационные дескрипторы эритро- и трео-. При этом сравнивают расположение одинаковых заместителей при двух асимметрических атомах в проекции Фишера. Стереоизомеры, в которых одинаковые заместители при асимметрических атомах углерода расположены по одну сторону от вертикальной линии, называют эритро-изомерами. Если такие группы находятся по разнные стороны от вертикальной линии, то говорят о трео-изомерах. В соединениях (I) -(IV) такими реперными -группами являются атомы водорода, и эти соединения получают следующие названия:

Отсюда видно, что обозначение относительной конфигурации у энантиомеров совпадает, а у диастереомеров - различается. Это важно, поскольку и в настоящее время установление абсолютной конфигурации энантиомеров - задача непростая. В то же время, различить диастереомеры достаточно легко, например, с помощью спектров ЯМР. При этом фраза "Из спектра следует, что в результате реакции получается эритро-2-бром-3-хлорбутан" означает, что речь идет об одном из энантиомеров: (I) или (II) [либо о рацемате, состоящем из (I)и (П)] (о каком именно - неизвестно), но не о соединениях (Ш) или (IV). Аналогично, фраза "Мы имеем дело с трео-2-бром-3-хлорбутаном" означает, что имеются в виду соединения (Ш) и (IV), но не (I) или (П).
Запомнить эти обозначения можно, например, так. В эритро-изомере одинаковые заместители "смотрят" в одну сторону, как и элементы буквы "А".
Приставки эритро- и трео- происходят от названий углеводов: треозы и эритрозы. В случае соединений с большим числом асимметрических атомов применяют другие стереохимические дескрипторы, также происходящие от названий углеводов (рибо-, ликсо-, глюко- и т.п.).
В другой варианте обозначения относительной конфигурации используют символы R* и S* При этом асимметрический атом, имеющий наименьший номер (в соответствии с правилами номенклатуры ИЮПАК), независимо от его абсолютной конфигурации, получает дескриптор R*. В случае соединений (I) - (IV) - это атом углерода, связанный с бромом. Второму асимметрическому атому в данной молекуле также придается дескриптор R*, если обозначения абсолютной конфигурации обоих асимметрических атомов совпадают (оба R или оба S).Так следует поступить в случае молекул (Ш) и (IV). Если же абсолютная конфигурация асимметрических атомов в молекуле имеет разное обозначение (молекулы I и II), то второй асимметрический атом получает дескриптор S*
 |  |  |  | |
| абсолютная конфигурация | (2S,3R) | (2R,3S) | (2S,3S) | (2R,3R) |
| относительная конфигурация | (2R*,3S*) | (2R*,3S*) | (2R*,3R*) | (2R*,3R*) |
Эта система обозначения относительной конфигурации, по существу, эквивалентна в эритро-трео-системе обозначений: у энантиомеров обозначения совпадают, а у диастереомеров - различаются. Разумеется, если у асимметрических атомов нет одинаковых заместителей, то относительную конфигурацию можно обозначить только с помощью дескрипторов R* и S*
VIII Методы Разделения энантиомеров.
Природные вещества, молекулы которых хиральны, являются индивидуальнымиэнантиомерами. Если же хиральный центр возникает в процессе химическойреакции, проводимой в колбе или промышленном реакторе, получается рацемат, содержащий равные количества двух энантиомеров. При этом возникает проблема разделения энантиомеров с целью получения каждого из них в индивидуальном состоянии. Для этого используют специальные приемы, называемые методами расщепления рацематов.
Метод Пастера.
Л.Пастер в 1848 г. обнаружил, что из водных растворов натриево-аммониевой соли виноградной кислоты (рацемат (+)- и (-)-винных кислот) при определенных условиях выпадают кристаллы двух типов, отличающиеся друг от друга как предмет и его зеркальное отображение. Пастер разделил эти кристаллы с помощью микроскопа и пинцета и получил в чистом виде соли (+)-винной кислоты и (-)-винной кислоты. Такой метод расщепления рацематов, основанный на самопроизвольной кристаллизации энантиомеров в двух различных кристаллических модификациях, получил название "метод Пастера". Однако, этот метод удается применить далеко не всегда. В настоящее время известно около 300 пар энантиомеров, способных к такой "самопроизвольной кристаллизации" в виде кристаллов разной формы. Поэтому были разработаны другие методы, позволяющие разделять энантиомеры.
 2017-11-01
2017-11-01 2747
2747








