Образование связи между двумя атомами происходит при сближении атомов с неспаренными электронами, спины которых антипараллельны. В результате взаимодействия электронов и ядер атомов образуется пара электронов, общая для обоих соединяющихся атомов. Возникает единое электронное облако, плотность которого между ядрами особенно велика, что обеспечивает наибольшее притяжение атомных ядер друг к другу и устойчивость молекулы в целом. Связь, возникающая за счет образования одной или нескольких электронных пар, которые становятся общими для двух соединяющихся атомов, называется ковалентной связью.
Образование связи сопровождается выделением энергии, которая в расчете на моль вещества называется энергией связи. Чтобы разорвать связь между атомами, необходимо затратить количество энергии, равное энергии связи. Суммарная энергия свободных атомов больше, чем энергия молекулы, из них образующейся.
Изменение энергии системы, состоящей из двух атомов, в зависимости от расстояния между ними можно иллюстрировать графиком потенциальной кривой молекулы водорода. За нуль принимают потенциальную энергию сближающихся атомов при расстоянии равном бесконечности. Следовательно, в этих условиях энергия их взаимодействия равна нулю. На рисунке по вертикальной оси отложены значения этой энергии, по горизонтальной — расстояния между ядрами атомов. В точке О находится один атом водорода, к нему движется по горизонтальной прямой другой атом. При сближении атомов возникают силы кулоновского притяжения между ядром первого атома и электроном второго, а также между ядром второго и электроном первого, и энергия системы убывает. При дальнейшем уменьшении расстояния наряду с силами притяжения действуют и силы отталкивания между ядрами и между электронами. На расстоянии 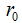 силы притяжения уравновешивают силы отталкивания. Это равновесное расстояние (
силы притяжения уравновешивают силы отталкивания. Это равновесное расстояние (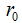 ), которому соответствует минимум энергии системы, называют длиной связи, или межъядерным расстоянием. При дальнейшем уменьшении r начинают преобладать силы отталкивания над силами притяжения и атомы расходятся, энергия системы резко возрастает. Для молекулы водорода длина связи составляет
), которому соответствует минимум энергии системы, называют длиной связи, или межъядерным расстоянием. При дальнейшем уменьшении r начинают преобладать силы отталкивания над силами притяжения и атомы расходятся, энергия системы резко возрастает. Для молекулы водорода длина связи составляет  кдж/моль.
кдж/моль.
Ковалентную связь можно рассматривать как взаимодействие электронов и ядер атомов, которое осуществляется благодаря волновым свойствам электронов, движущихся в пространстве между ядрами.
Условно образование связи можно представить как соединение двух электронов в одной молекулярной энергетической ячейке, энергетический уровень которой ниже, чем исходных атомных энергетических ячеек.
В молекулах газообразных веществ, таких как Н2, N2, С12, атомы соединены ковалентной связью. В образовании этой связи участвуют неспаренные электроны внешнего энергетического уровня. Схематично атом изображают символом элемента и около него ставят точки, число которых должно соответствовать числу наружных электронов.
Например: 
При взаимодействии двух атомов водорода между ними образуется одна общая электронная пара: 
У каждого из соединяющихся атомов хлора имеется по одному неспаренному электрону, при взаимодействии которых возникает общая электронная пара. Образование молекулы хлора можно представить схемой: 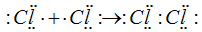
В молекуле хлора каждому атому соответствуют 8 электронов внешнего слоя. Отмечено, что устойчивые молекулы и сложные ионы имеют такое строение, при котором каждый атом достигает электронной конфигурации инертного элемента ( ). Эту часто наблюдаемую закономерность называют правилом октета. Между атомами может быть не только одна, но и две и три общие электронные пары. Так, атомов азота имеются три неспаренных электрона, поэтому атомы соединяются друг с другом тремя электронными парами
). Эту часто наблюдаемую закономерность называют правилом октета. Между атомами может быть не только одна, но и две и три общие электронные пары. Так, атомов азота имеются три неспаренных электрона, поэтому атомы соединяются друг с другом тремя электронными парами 
Эти электронные пары являются общими для обоих атомов, поэтому каждый атом азота имеет во внешнем слое 8 электронов.
Валентность элемента в соединении с ковалентной связью определяется числом неспаренных электронов, участвующих в образований общих электронных пар. Например, структурная формула имеет вид: 
 2018-01-21
2018-01-21 586
586








