Лекція 1.
Альдегіди
Визначення:
Альдегіди – це складні органічні речовини, у яких вуглеводневий радикал поєднаний з функціональною альдегідною групою – карбонільною групою:
O
R−C
H
Скорочено альдегідну групу позначають –СНО. Загальна формула насичених альдегідів СnH2nO.
Гомологічний ряд альдегідів:
| Формула альдегіда СnH2nO | Назва за номенклатурою IUPAC | Тривіальна (історична) назва |
| НСНО | Метаналь | Мурашиний альдегід, формальдегід |
| СН3СНО | Етаналь | Оцтовий альдегід, ацетальдегід |
| С2Н5СНО | Пропаналь | Пропіоновий альдегід |
| С3Н7СНО | Бутаналь | Масляний альдегід |
| С4Н9СНО | Пентаналь | Валеріановий альдегід |
Будова:
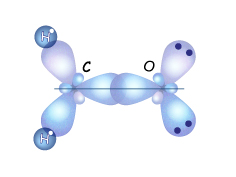 Між атомами Карбону й Оксигену в молекулах альдегідів утворюється подвійний зв'язок.
Між атомами Карбону й Оксигену в молекулах альдегідів утворюється подвійний зв'язок.
Атом Карбону карбонільної групи перебуває у стані
Sp2-гібридизації і за рахунком Sp2-гібридизованих хмар
утворюються три ς -зв’язки, а одна π -електронна
хмара цього атома Карбону перекривається з π-орбіталлю
атома Оксигену й утворює π-зв’язок.
Оскільки атом Оксигену більш електронегативний, ніж атом Карбону, то подвійний зв’язок карбонільної групи є високо поляризованим і на атомі Оксигену є надлишок електронної густини, тобто частковий заряд δ-, а на атомі Карбону нестача густини, тобто частковий заряд δ+. Алкільний радикал має електронно-донорні властивості властивості і зменшує негативний заряд Оксигену карбонільної групи. Таким чином С=О стає менш полярним і тому активність зменшується.
Фізичні властивості:
Метаналь або формальдегід – газ, наступні гомологи – рідини, а починаючи з пальмітинового С16Н31-СОН – тверді речовини. Метаналь і етаналь добре розчинні в воді. Метаналь – отруйна речовина.
1. Горіння. Альдегіди повністю окиснюються до вуглекислого газу і води.
СН2О+О2àCO2+H2O
2. Часткове окиснення. Продуктами часткового окиснення альдегідів є карбонові кислоти.
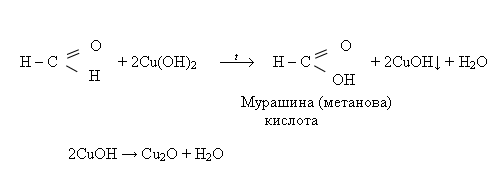
a. Альдегіди вступають у реакції окиснення з купрум(ІІ) гідроксидом, при цьому утворюється жовтий осад купрум(І) гідроксиду, що відразу розкладається на купрум(І) оксид червоного кольору і воду:
б. Реакція окиснення амоніачним розчином аргентум(І) оксиду відбувається за схемою:
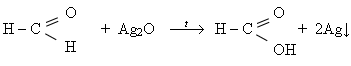
Цю реакцію називають " реакцією срібного дзеркала", оскільки на стінках посуду, в якому проводять реакцію, осідає металічне срібло.
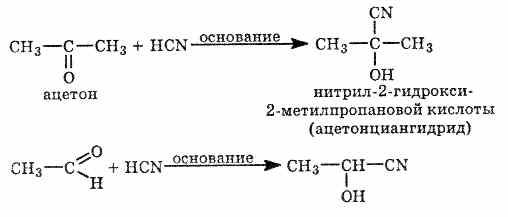
3. Приєднання. За подвійним зв'язком в альдегідній групі відбувається приєднання водню, при цьому альдегіди відновлюються до спиртів.
· СН3СНО+Н2àCH3-CH2OH (за умовою t, Ni)
· 
· 
4. Полімеризація та поліконденсація. Якщо сполучаються три молекули ацетальдегіду, то утворюється метальдегід, відомий як "сухий спирт":
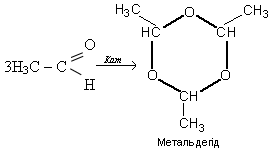
На відміну від реакції полімеризації внаслідок реакції поліконденсації не лише утворюється полімер, а й виділяється низькомолекулярна речовина. Поліконденсацією формальдегіду і фенолу добувають цінний полімер – фенолоформальдегідну смолу.
5. Реакції заміщення:
А) 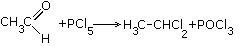
Б) СН3-CHO + Cl2 hv СН3-COCl + HCl
Добування
1.Важливим методом добування ацетальдегіду є гідратація ацетилену за методом Кучерова Реакція відбувається за участю каталізатора – суміші сульфатної кислоти і меркурій(ІІ) сульфату та з утворенням проміжного продукту реакції:
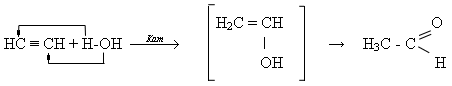
2. каталітична дегідрогенізація первинних спиртів 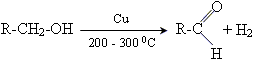
3. окислення первинних спиртів
| CuO, t |
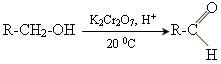
4. Гідроліз дігалогенопохідних
СН3–СН2–СН–CI2 + HOH 2HCl + CH3 – CH2 – CH = O
Застосування:
А) Формальдегід
Застосовують у виробництві термореактивних пластмас, феноло – формальдегідних та сечовино – формальдегідних смол. Формальдегід є біологічно активною речовиною: під його впливом відбувається згортання (денатурація) білка. На цьому ґрунтується його (точніше його водного розчину - формаліну) застосування як засобу для дезінфекції, як дубильного засобу та консерванта для анатомічних препаратів. Формаліном називають 37 – 40% водний розчин формальдегіду, до якого як інгібітор полімеризації додають 6-15% метанолу. У медицині також використовують похідні формальдегіду – уротропін.
Б) Ацетальдегід
Найважливіші застосування оцтового альдегіду ґрунтуються на використанні його реакцій окиснення та відновлення. За допомогою першої з них добувають оцтову кислоту, за допомогою другої – етанол (у деяких країнах). Основне застосування оцтового альдегіду – добування оцтової кислоти.
Інші альдегіди в промисловості застосовують не так часто. Деякі альдегіди, які мають приємний запах, використовують у парфумерії та косметиці.
Лекція 2.
Кетони
Визначення:
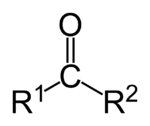 Кетони - органічні речовини, в яких карбонільна група зв'язана з двома вуглеводневими радикалами
Кетони - органічні речовини, в яких карбонільна група зв'язана з двома вуглеводневими радикалами
Загальна формула:
Номенклатура: Обирають найдовший ланцюг, атоми нумерують так, щоб атом Карбону карбонільної групи отримай найменший номер.
Фізичні властивості:
Ацетон – безбарвна рідина з характерним запахом і tкипіння=56оС, добре розчиняється у воді й переважній більшості органічних розчинників. Ацетон та його гомологи до С4Н9-С-С4Н9 включно – рідини, далі – тверді речовини.
Зумовлені наявністю карбонільної групи. Завдяки цьому між атомами карбону й оксигену полярного подвійного зв’язку кетони вступають в реакції приєднання внаслідок розриву π-зв’язку карбонільної групи. Однак у молекулах кетонів, внаслідок впливу на карбонільну групу 2х вуглеводневих радикалів. Величина заряду δ+ на атомі карбону карбонільної групи менша, ніж у молекулі альдегіду. Тому карбонільна група кетонів хімічно значно менш активна ніж карбонільна група альдегідів.
1. приєднання водню
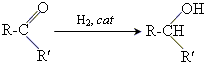
2. реакції окислення для кетонів протікають лише під дією дуже сильних окислювачів і супроводжуються розривом вуглецевого ланцюга. кетони не дають реакцію срібного дзеркала і не окислюються гідроксидом Купруму(ІІ).
3. OH
CH3—CO—CH3 + HCN CH3 – C – CH3
C≡N
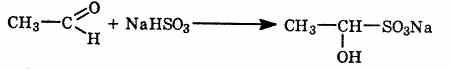
4. OH
CH3—CO—CH3 + NaHSO3 CH3 – C – CH3
SO3Na
Добування кетонів
1. окислення вторинних спиртів
| CuO, t |
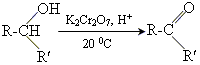
5. Гідроліз дігалогенпохідних
СН3 – СCl2 – CH3 + HOH 2HCL + CH3 – CO – CH3
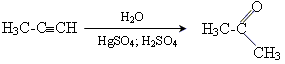
3. Дегідратація вторинних спиртів:
CH3—CH(OH)—CH3  CH3—CO—CH3 + H2
CH3—CO—CH3 + H2
Лекція 3.
Карбонові кислоти
Визначення:
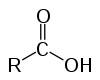 Карбонові кислоти – це органічні сполуки, в молекулах яких міститься функціональна карбоксильна група яка пов’язана з вуглеводневим радикалом.
Карбонові кислоти – це органічні сполуки, в молекулах яких міститься функціональна карбоксильна група яка пов’язана з вуглеводневим радикалом.
Загальна формула:
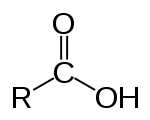 Закінчення «ова»
Закінчення «ова»
Гомологічний ряд:
| Формула | Назва за ІЮПАК | Тривіальна назва | ||||
| НСООН | метанова кислота | мурашина кислота | ||||
| СН 3-СООН | етанова кислота | оцтова кислота | ||||
| СН 3-СН 2-СООН | пропанова кислота | пропіонова кислота | ||||
| СН 3 - (СН 2) 2-СООН | бутанова кислота | масляна кислота | ||||
| СН 3 - (СН 2) 3-СООН | пентанова кислота | валеріанова кислота | ||||
| СН 3 - (СН 2) 14-СООН | гексадекановая кислота | пальмітинова кислота | ||||
| СН 3 - (СН 2) 15-СООН | гептадекановая кислота | маргаринова кислота | ||||
| СН 3 - (СН 2) 16-СООН | октадекановая кислота | стеаринова кислота | ||||
| СН 3 - (СН 2) 17-СООН | нонадекановая кислота | стеаринова кислота | ||||
| СН 3 - (СН 2) 18-СООН | бензолкарбоновая кислота | бензойна кислота | ||||
Будова: Атом кисню, сполучений з вуглецем подвійним зв’язком
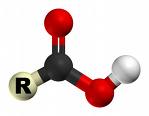 витягує електрони до себе і Карбон набуває деякого
витягує електрони до себе і Карбон набуває деякого
позитивного заряду і притягує до себе електрони від
другого атома кисню з групи –ОН, що викликає зміщення
електронної хмари зв’язку О-Н до атома кисню. Чим
більше в кислоті радикалів, там менша полярність зв’язку
ОН, а значить тим складніше кислота дисоціює, тому реактивна здатність збільшується знизу до гори.
Чим більше катіонів Н+ утворюється при дисоціації, тим більше кислотність.
Фізичні властивості:
До С4 – з характерним запахом, змішується з водою у будь-яких співвідношеннях.
С4-С10 – маслянисті, неприємний запах, погано розчиняється у воді.
Вищі карбонові кислоти – тверді нерозчинні у воді, добре розчиняються у спиртах. Молекули дисоціюють і утворюють димери завдяки водневому зв’язку.
1. Карбонові кислоти при реакції з металами, їх оксидами або їх основними гідроксидами дають солі відповідних металів, реагують зі всіма металами до Н2, окрім лужних:
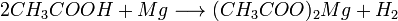
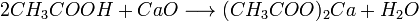
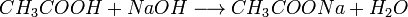
2. Карбонові кислоти можуть витісняти більш слабку кислоту з її солі, наприклад:
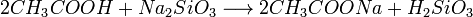
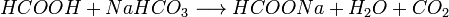
| H2SO4(к) |
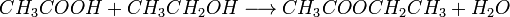
| t |
CH3COOH + NH3 CH3COONH4
б) При нагріванні амонійних солей карбонових кислот утворюються їх аміди:
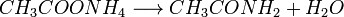
 5. Під дією карбонові кислоти перетворюються в відповідні хлорангідриди:
5. Під дією карбонові кислоти перетворюються в відповідні хлорангідриди:
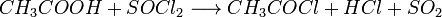
7. Дисоціює на йони:
CH3COOH CH3COO– + H+
Якісні реакції:
1. CH3COOH лакмус червоний
2. СH3COOH + NaHCO3 → CH3COONa + H2O + CO2
3. 2CH3COOH + FeCl3 FeOH (CH3COO)2 + 3HCl
(темно-червоний колір)
Добування:
- Подвійне окислення спиртів
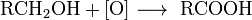 + H2O
+ H2O
Cat [K2Cr2O7, H+]
 [KMnO4, H+]
[KMnO4, H+]
- Окислення альдегідів

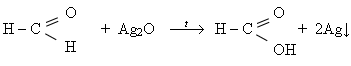
- Гідроліз трігалогеналканів
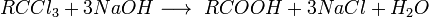
- Карбоксилювання металоорганічних сполук
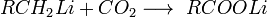
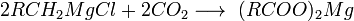
- Гідроліз складних ефірів
| Водний розчин |
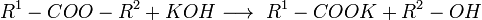
Застосування:
Мурашина кислота застосовується як протрава для фарбування шерсті, консервант фруктових соків і силосу, використовується для дезінфекції місткостей у харчовій промисловості, у хімічних синтезах.
Оцтова кислота застосовується для добування пластмас, барвників, ліків, штучних волокон, кіноплівки в хімічних синтезах. Вона використовується як приправа до їжі, для консервації овочів. Солі оцтової кислоти використовують для фарбування тканин, а також для боротьби зі шкідниками сільського господарства.
Лекція 4.
Мурашина Кислота
Мурашина кислота (метанова кислота) НСООН являє собою рідину (t пл.=8,30С; t кип.=100,80С) з дуже різким запахом; добре розчиняється у воді і етиловому спирті; проявляє бактерицидні властивості. Солі мурашиної кислоти називаються форміатами.
Вперше мурашину кислоту було виявлено у їдких виділеннях мурах. Мурашина кислота вміщується також у кропиві.
У промисловості мурашину кислоту отримують наступним методом:
CO + NaOH → HCOONa;
HCOONa + H2SO4 → HCOOH + NaHSO4.
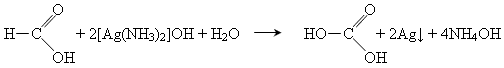 Для мурашиної кислоти характерними є всі властивості карбонових кислот. До особливостей слід віднести виражені відновні властивості мурашиної кислоти, наприклад, реакцію срібного дзеркала:
Для мурашиної кислоти характерними є всі властивості карбонових кислот. До особливостей слід віднести виражені відновні властивості мурашиної кислоти, наприклад, реакцію срібного дзеркала:
Лекція 5.
Бензойна кислота
Бензойна кислота C6H5-СООН являє собою білу кристалічну речовину (t пл.=122,30С; t кип.=249,20С); погано розчиняється у воді, але добре розчиняється в органічних розчиннниках - етиловому спирті, бензолі; проявляє бактерицидні властивості.
1. 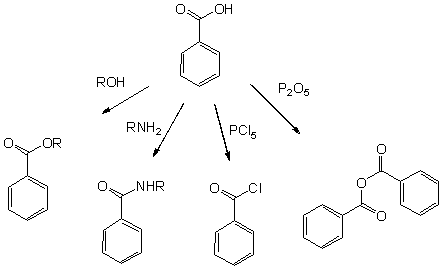 Утворює солі
Утворює солі
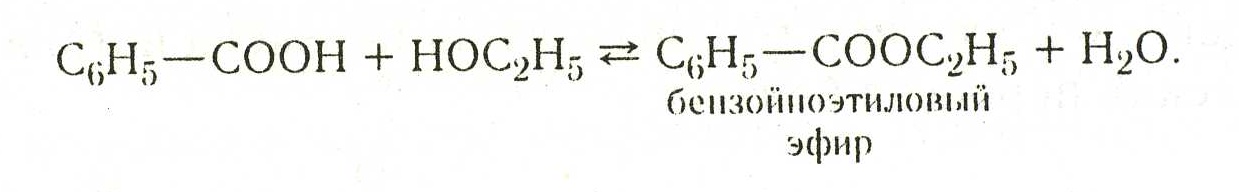
2.
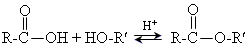
3.
4. 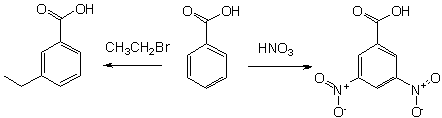
Добування:
1. При окисленні толуену киснем повітря, або нітратною кислотою:
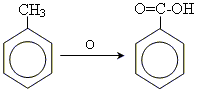
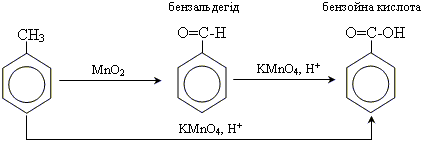
2.
Застосування:
Для виробництва барвників та ліків. Солі й ефіри використовують як антисептики і консерванти.
Назви радикалів кислот
· форміл HCO-
· форміат HCO-О-
· ацетил CH 3 CO-
· ацетат CH 3 CO-О-
· пропіоніл CH 3 CH 2 CO-
· пропіонат CH 3 CH 2 CO-О-
· бутіріл CH 3 CH 2 CH 2 CO-
· бутірат CH 3 CH 2 CH 2 CO-О-
· валеріл CH 3 CH 2 CH 2 CH 2 CO-
· валеріат CH 3 CH 2 CH 2 CH 2 CO-О-
 2018-01-21
2018-01-21 3195
3195








