
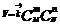 E=hn
E=hn
Общие cв-ва растворов
РА=Ра*ХА, ХА=(1-ХВ), VU=KUSXA 
2й Закон Рауля
 ,
, 
 ,
, 
ПОСМ=СmRT
Р-ры электролитов
i-изотонический коэф. Pосм=iC(B)RT êT=iKCm(B) êTкип=iECm(B)
a=(i-1)/(n-1) KD=Ca2/(1-a) Закон Освальда
aH+>10-7 aOH-<10-7 – кислая Кг=Ка*аН2О Кг-const диссоц.
Количественные характеристики ОВР
Мэк. окисл.=Мок/Zприс. êЕ0=Е0ок-Е0ок êG0=-nFêE0 êE0>0-возмож.
Равновесие на границе раздела фаз.

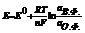 - Нерст
- Нерст
 2018-01-21
2018-01-21 374
374







