Скорость реакции зависит от природы реагирующих веществ, концентрации реагентов, температуры, внешних воздействии. По правилу Вант-Гофа при увелечении температуры на 10 градусов скорость большинства реакции возрастает в 2-4 раза:
Vt2=Vt1* 
Аррениус установил функциональную зависимость константы скорости хим.реакции k от t:k= A* 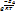
где А - предэкспонциональный множитель, представляющий собой полную частоту соударения между молекулами реагирующих веществ,
 - энергия активации;
- энергия активации; 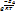 - доля молекул, обладащих избыточной энергией Еа по сравнению со средней энергией молекулы.
- доля молекул, обладащих избыточной энергией Еа по сравнению со средней энергией молекулы.
Энергия активации – это некоторое избыточное кол-во внутренней энергии (по сравнению со средней), которым должна обладать молекула, чтобы прореагировать в данной хим.реакции. энергия активации необходима для преодоления сил отталкивания между сближающимися молекулами, ослабление и нарушение связей в молекулах реагирующих веществ. Чем больше значении энергии актиывации, тем меньше скорость реакции и наоборот.
 2018-01-21
2018-01-21 698
698








