Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO₃= 2KCl + 3O₂↑
Константа химического равновесия
Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации Сi, парциальные давления Pi или мольные доли Xi реагирующих веществ. Для некоторой реакции
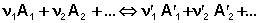
соответствующие константы равновесия выражаются следующим образом:
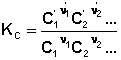 (1)
(1) 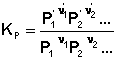 (2)
(2) 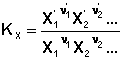 (3)
(3)
Классификация растворов: по степени дисперсности, по степени насыщенности. Коллигативные свойства растворов: закон Рауля, понижение температуры замерзания раствора, повышение температуры кипения раствора.
Насыщенность:
По соотношению преобладания числа частиц, переходящих в раствор или удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
|
|
|
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, - ненасыщенным.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества, и раствор становится насыщенным.
Дисперсность:
1) Грубодисперсные - размер частиц - 10⁻⁷ - 10⁻⁵м;
2) Коллоидно-дисперсные- размер частиц- 10⁻⁹ - 10⁻⁷ м;
3) Молекулярно-дисперсные и ионно-дисперсные (истинные растворы)- размер частиц меньше 10⁻⁹ м.
Коллигативные свойства растворов —зависят лишь от количества кинетических единиц и от их теплового движения.
1 Закон Рауля:
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p = p0 · χр-ль, где
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем;
χр-ль — мольная доля растворителя.
2 Закон Рауля:
повышение температуры кипения раствора по сравнению с температурой кипения растворителя, а равно и понижение температуры замерзания раствора по сравнению с аналогичным характеризующей величиной для растворителя прямо пропорциональна моляльности раствора:
|
|
|
ΔTкип/зам= Kкип/зам · mв-ва, где
Kэб/кр —константы, характерные для данного растворителя;
mв-ва — моляльность вещества в растворе.
Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
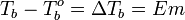
Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора.
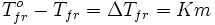
 2018-01-21
2018-01-21 587
587








