Предмет химической термодинамики. Термодинамические системы, виды термодинамических систем, параметры состояния, параметры процесса
2.
Термодинамикой называется раздел физики, изучающий взаимные превращения теплоты и других видов энергии.
Химическая термодинамика является приложением термодинамики к химическим явлениям и изучает взаимные превращения между химической энергией, теплотой и другими видами энергии. Основной объект изучения химической термодинамики термодинамическая система.
Термодинамической системой называют совокупность тел, которая фактически или мысленно выделяется из окружающей среды.
В зависимости от характера взаимодействия с окружающей средой термодинамические системы подразделяют на:
1. Изолированные.
2. Закрытые.
3. Открытые.
Изолированные – системы, лишенные возможности обмена с окружающей средой веществом и энергией, имеющие постоянный объем.
Близким по свойствам к изолированной системе является
закрытый термос с горячим чаем.
Закрытые – системы, лишенные возможности обмена с окружающей средой веществом, но имеющие возможность обмениваться с ней энергией и не обязательно сохраняющие постоянный объем. Пример: электрическая лампочка.
Открытые – системы, имеющие возможность обмена с окружающей средой веществом и энергией, а также способные изменять свой объем. Пример: живые организмы.
По пространственному распределению свойств внутри системы различают: гомогенные и гетерогенные системы.
1. Гомогенные системы - это системы, внутри которых нет поверхностей раздела, отделяющих друг от друга части системы, различающиеся по свойствам. Например: раствор в воде поваренной соли.
2. Гетерогенные системы - это системы, внутри которых есть поверхности раздела, отделяющие друг от друга части системы (фазы), различающиеся по свойствам. Например: налитая в бокал газированная вода, в ней имеется как жидкая фаза, так и пузырьки выделяющегося углекислого газа.
Состояние системы в термодинамике задается совокупностью измеримых физических величин, называемых параметрами состояния. Это, например, объем, давление, температура, концентрация…
Уравнения, связывающие параметры состояния системы называются уравнениями состояния.
Например, уравнением состояния для идеального газа является уравнение Клапейрона-Менделеева:
PV = nRT
P- давление, Па;
V – объем, м3;
n – количество вещества, моль;
R – универсальная газовая постоянная, 8, 314 Дж/моль К;
T – температура, градусы Кельвина.
Легко запомнить численное значение R: 8 + три первые цифры числа π: 8, 314.
Чтобы легко запомнить размерность универсальной газовой постоянной нужно знать ее физический смысл – это работа, которую производит 1 моль идеального газа, расширяясь при нагревании на один градус Кельвина, отсюда размерность Дж/моль·К.
Всякое изменение, происходящее в системе и сопровождающееся изменением хотя бы одного из параметров состояния, называется термодинамическим процессом или кратко, процессом.
Термодинамическим параметром процесса называется термодинамическая величина, служащая для характеристики процесса (внутренняя энергия, тепловой эффект реакции и т.д.).
Конечное изменение какого-либо термодинамического параметра процесса обозначается Δx = x2 - x1, где = x2 – значение данного параметра в конце, а x1 – в начале процесса.
Бесконечно малые изменения обозначаются: (дельта) δx или dx.
Те термодинамические параметры процесса, которые зависят только от состояния системы, называются функциями состояния, и их изменение в каком-либо процессе зависит только он начального и конечного состояния системы и не зависит от пути этого изменения.
С математической точки зрения функция состояния системы это: f(P, V, T…).
Процесс, при котором термодинамическая система, выйдя из начального состояния и претерпев ряд изменений, возвращается в исходное состояние, называется круговым. При этом все значения параметров состояния системы (температура, давление, концентрации…) возвращаются к исходным значениям. Отсюда для кругового процесса для всех функций состояния системы:
Δx = x2 - x1 = 0
Важнейшей функцией состояния системы является внутренняя энергия. Понятие внутренней энергии было сформулировано на основании многочисленных опытов и наблюдений за взаимными превращениями теплоты и работы. Немецкий ученый Рудольф Клаузиус (1822-1888) обобщил эти наблюдения в принципе эквивалентности теплоты и работы (1850 г.):
«Во всех случаях круговых процессов, когда из теплоты появляется работа, тратится пропорциональное полученной работе количество тепла, и, наоборот, при затрате той же работы получается то же количества тепла».
Математически: Q = W илиQ – W=0
Но это значит, что Q – W не изменяется в круговом процессе и, следовательно, является функцией состояния системы, получившей название внутренней энергии и обозначаемой U.
Принцип эквивалентности теплоты и работы получил название первого закона термодинамики и сегодня формулируется следующим образом:
Если в каком-либо процессе энергия одного вида исчезает, то взамен ее появляется энергия другого вида в количестве, строго эквивалентном первому.
Внутренняя энергия характеризует общий запас энергии системы, включая энергию поступательного и вращательного движения молекул, энергию движения электронов и ядер. Но внутренняя энергия не включает кинетическую энергию системы в целом и потенциальную энергию, обусловленную положением системы.
Пример: внутренняя энергия кусочка мела не изменится, если переложить его со стола на пол или бросить в окно.
Сегодня не существует методов определения абсолютной величины внутренней энергии, но можно вычислить изменение внутренней энергии в каком-либо процессе.
ΔU = Q –W
где: Q – количество тепла поглощенное системой,
W– совершенная системой работа.
В зависимости от условий, в которых осуществляются процессы их подразделяют:
1. Изотермические – протекающие при постоянной температуре.
2. Изобарные – протекающие при постоянном давлении.
3. Изохорные – протекающие при постоянном объеме.
Применим первый закон термодинамики к некоторым процессам, происходящим в идеальных газах.
Изохорный процесс, V=const
При V=const, W= P·ΔV =0,
отсюда: ΔU = Qv –W = Qv (Qv- обозначение теплоты процесса при постоянном объеме).
Теплота, сообщенная системе при постоянном объеме, затрачивается на изменение ее внутренней энергии. Поскольку внутренняя энергия функция состояния системы то и теплота изохорного процесса тоже является функцией состояния системы, то есть не зависит от пути перехода системы из одного состояния в другое.
Изобарный процесс, P=const
В изобарном процессе совершается работа расширения:
W = P(V2 - V1), подставим эту величину в уравнение для первого закона термодинамики: ΔU = Q –W
ΔU = Qp – P(V2 - V1), отсюда: Qp= ΔU + P(V2 - V1) =
=U2 – U1+ PV2 - PV1 = (U2 +PV2) - (U1 +PV1)
Это значит, что теплота процесса при постоянном давлении равна разности значений функции, имеющей вид:
U +PV = H, эта функция названа энтальпией.
Откуда: Qp= H2 – H1
Изменение энтальпии также не зависит от пути процесса, а определяется только начальным и конечным состоянием системы, то есть энтальпия является функцией состояния системы. А потому функцией состояния системы является и теплота изобарного процесса.
Независимость теплот изохорного и изобарного процессов от их пути подтверждается открытым опытным путем в 1840 г. российским химиком Германом Гессом закон (закон Гесса):
Тепловой эффект химических реакций зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути перехода системы из начального в конечное состояние.
Схема, иллюстрирующая закон Гесса изображена на рисунке 1.
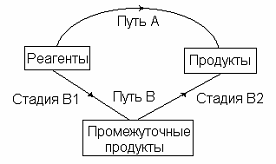
Рис.1. Независимость теплового эффекта процесса от его пути: QA = QB = QB1 + QB2
Закон Гесса является вполне строгим только для изохорных и изобарных процессов.
На практике более удобно исследовать изобарные процессы. Поэтому чаще вычисляют и используют изменения энтальпии.
Но теплоты изобарного и изохорного процессов взаимосвязаны. Ранее было показано, что:
Qp= ΔU + P(V2 - V1), но поскольку ΔU = Qv, то Qp= Qv + P(V2 - V1)
Из закона Клапейрона-Менделеева: PV = nRT, отсюда:
P(V2 - V1) = (n2 - n1)RT, следовательно:
Qp= Qv, + (n2 - n1)RT
Если в процессе реакции суммарное количество веществ остается постоянным: (n2 - n1)=0 или не происходит изменения объема реакционной смеси: (V2 - V1)=0, то в этом случае:
Qp= Qv и, соответственно, ΔH = ΔU
Таким образом, в газовых реакциях, если не происходит суммарного изменения количества газообразных веществ, а также в реакциях между твердыми и жидкими веществами, если не происходит заметного изменения общего объема реакционной смеси изохорная и изобарная теплоты процесса равны.
Поскольку тепловые эффекты химических процессов зависят от условий их проведения, то чтобы сделать полученные результаты сопоставимыми они должны быть получены при одинаковых условиях. В качестве стандартных приняты условия, когда парциальное (приходящееся на отдельный компонент) давление каждого газообразного компонента в системе составляет 1,013 · 105 Па, а температура 298,16. Если вещество образует несколько аллотропных или кристаллических модификаций, то стандартной считается та, которая устойчива при стандартных температуре и давлении.
Термодинамические величины, характеризующие вещество в стандартном состоянии называются стандартными термодинамическими величинами. Изменения этих величин в процессах, идущих в стандартных условиях, называют стандартными изменениями термодинамических величин и обозначают буквами с верхним индексом “0”: ΔH0, ΔU0…
При проведении расчетов большое значение имеют стандартные энтальпии образования сложных веществ. Это ΔH0 реакций образования 1 моль сложного вещества из простых веществ.
Значения стандартных энтальпий образования имеются в справочной литературе. Например: ΔH0 обр.(NH3) = - 45, 94 кДж/моль
Стандартные энтальпии образования простых веществ, устойчивых при данных условиях, принимаются равными 0.
Широкое применение имеют также стандартные энтальпии сгорания веществ. Это ΔH0 реакций сгорания 1 моля вещества до CO2(г), H2O(ж) или других устойчивых в стандартных условиях соединений.
Значения стандартных энтальпий сгорания веществ также имеются в справочной литературе.
Например: ΔH0 сгор.(С2H2) = - 1300 кДж/моль
Использование взятых из справочной литературы величин стандартных энтальпий образования и сгорания позволяет производить расчет тепловых эффектов химических реакций. Такого рода расчеты базируются на использовании термохимических уравнений.
 2018-01-21
2018-01-21 422
422







